题目内容
17.下列关于钠及其化合物的说法错误的是( )| A. | 钠、过氧化钠、氢氧化钠、碳酸钠灼烧时火焰呈黄色 | |
| B. | 切开的金属钠暴露在空气中,光亮的表面变暗发生2Na+O2═Na2O2反应 | |
| C. | 过氧化钠在潮湿空气放一段时间变成白色粘稠物的反应主要是:2Na2O2+2H2O═4NaOH+O2↑ | |
| D. | 过氧化钠投入硫酸铜溶液可产生氢氧化铜沉淀和氧气 |
分析 A.钠的焰色为黄色,焰色反应为元素性质;
B.钠与氧气常温下反应生成氧化钠;
C.过氧化钠与水反应生成氢氧化钠;
D.过氧化钠投入硫酸铜溶液反应生成氢氧化铜,硫酸钠和氧气.
解答 解:A.焰色反应为元素性质,钠的焰色为黄色,故A正确;
B.钠与氧气常温下反应生成氧化钠,故B错误;
C.过氧化钠与水反应生成氢氧化钠2Na2O2+2H2O═4NaOH+O2↑,氢氧化钠潮解得到氢氧化钠溶液,故C正确;
D.过氧化钠投入硫酸铜溶液反应生成氢氧化铜,硫酸钠和氧气,所以看到现象,产生氢氧化铜沉淀和氧气,故D正确;
故选:B.
点评 本题考查了物质的性质,熟悉钠、过氧化钠的性质是解题关键,注意焰色反应属于元素的性质,题目难度不大.

练习册系列答案
相关题目
7.硝酸被称为“国防工业之母”是因为它是制取炸药的重要原料.下列实验事实与硝酸性质不相对应的一组是( )
| A. | 浓硝酸使紫色石蕊试液先变红后褪色--酸性和强氧化性 | |
| B. | 不能用稀硝酸与锌反应制氢气--强氧化性 | |
| C. | 要用棕色瓶盛装浓硝酸--稳定性 | |
| D. | 能使滴有酚酞的氢氧化钠溶液红色褪去--强氧化性 |
5.下列说法正确的是( )
| A. | 化合反应均是放热反应 | B. | 中和反应都是放热反应 | ||
| C. | 吸热反应只吸收外界能量 | D. | 氧化还原反应均是放热反应 |
12.为提纯下列物质(括号内为杂质)选用的试剂和分离方法都正确的是( )
| 物质 | 试剂 | 分离方法 | |
| ① | 溴苯(溴) | 氢氧化钠溶液 | 分液 |
| ② | CO2(HCl) | 饱和Na2CO3溶液 | 洗气 |
| ③ | 乙酸乙酯(乙酸) | NaOH溶液 | 分液 |
| ④ | Cl2(HCl) | 饱和NaCl溶液 | 洗气 |
| A. | ①③ | B. | ①④ | C. | 只有 ④ | D. | ③④ |
2.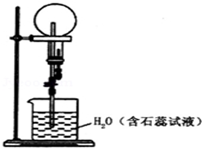 已知NH3和HCl都能用来作喷泉实验的气体,若在相同条件下用等体积烧瓶各收集满NH3和HCl气体,进行实验(两烧瓶内充满溶液且不考虑溶质的扩散).下列说法正确的是( )
已知NH3和HCl都能用来作喷泉实验的气体,若在相同条件下用等体积烧瓶各收集满NH3和HCl气体,进行实验(两烧瓶内充满溶液且不考虑溶质的扩散).下列说法正确的是( )
 已知NH3和HCl都能用来作喷泉实验的气体,若在相同条件下用等体积烧瓶各收集满NH3和HCl气体,进行实验(两烧瓶内充满溶液且不考虑溶质的扩散).下列说法正确的是( )
已知NH3和HCl都能用来作喷泉实验的气体,若在相同条件下用等体积烧瓶各收集满NH3和HCl气体,进行实验(两烧瓶内充满溶液且不考虑溶质的扩散).下列说法正确的是( )| A. | NH3和HCl分别形成红色、蓝色喷泉 | |
| B. | 制备干燥的NH3和HCl,可分别用无水CaCl2、碱石灰干燥 | |
| C. | 改为NO2气体,所得溶液溶质的物质的量浓度与前两者不同 | |
| D. | 去掉装置中的胶头滴管,改为单孔塞,也可引发喷泉 |
9.下列说法正确是( )
| A. | 4.6g有机物C2H6O的分子结构中含有的C-H键数目一定为0.5Na | |||||||||||
| B. | 用惰性电极电解足量氯化钠溶液,当阴极生成气体质量为2g时,溶液中转移电子数为2Na | |||||||||||
| C. | 一定温度下,若用Kw表示水的离子积,Kb表示一水合氨的电离常数,则该温度下水解平衡常数K=$\frac{{K}_{W}}{{K}_{b}}$ | |||||||||||
| D. | 已知如表所示数据:
|
6.下面各项有机化合物的分类方法及所含官能团不正确的是( )
| A. |  醛类 醛类 | B. |  醇类-OH 醇类-OH | C. |  酯类 酯类 | D. | CH3COOH羧酸类  |
16.利用如图所示装置可以将铜牌变为银牌,即在铜牌表面电镀一层银.下列有关说法中正确的是( )
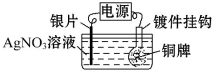

| A. | 通电后,Ag+向阳极移动 | |
| B. | 银片与电源负极相连 | |
| C. | 该电解池的阴极反应可表示为Ag++e-═Ag | |
| D. | 当电镀一段时间后,将电源反接,铜牌可恢复如初 |
