题目内容
11.乙二酸(HOOC-COOH,可简写为H2C2O4)俗称草酸,在100℃开始升华,157℃时开始分解.(1)探究草酸的酸性
①已知:25℃H2C2O4 的电离常数 K1=5.4×10?2,K2=5.4×10?5;H2CO3的电离常数 K1=4.5×10?7,K2=4.7×10?11则下列化学方程式正确的是B(填选项序号,下同)
A.H2C2O4+CO32?=HCO3?+HC2O4?
B.HC2O4?+CO32?=HCO3?+C2O42?
C.H2O+CO2+C2O42?=HC2O4?+HCO3?
D.C2O42?+CO2+H2O=H2C2O4+CO32?
②向1L 0.02mol/L H2C2O4溶液中滴加1L 0.01mol/L NaOH溶液.混合溶液中c(H+)>c(OH-),下列说法中正确的是B.
A.c(H2C2O4)>c(HC2O4?)
B.c(Na+)+c(H+)=2c(C2O42?)+c(HC2O4?)+c(OH-)
C.c(OH-)=c(H+)+2c(H2C2O4)+c(HC2O4?)
D.c(H2C2O4)+c(C2O42?)+c(HC2O4?)=0.02mol/L
(2)用酸性KMnO4溶液滴定含杂质的Na2C2O4样品(已知杂质不与KMnO4和H2SO4溶液反应).
实验步骤:
准确称取1g样品Na2C2O4固体,配成100mL溶液,取出20.00mL于锥形瓶中.再向瓶中加入足量稀H2SO4溶液,用0.016mol/L高锰酸钾溶液滴定,滴定至终点时消耗高锰酸钾溶液25.00mL.
(已知:5H2C2O4+2KMnO4+3H2SO4=10CO2↑+2MnSO4+K2SO4+8H2O)
①高锰酸钾溶液应装在酸式滴定管中.(填“酸式”或“碱式”)
②滴定至终点时的实验现象是:无色变为紫色(紫红色),且半分钟内不褪色.
③下列操作可能使测量结果偏高的是B;;
A.盛装的Na2C2O4的滴定管没润洗
B.盛装高锰酸钾溶液的滴定管滴定前尖嘴处有气泡,滴定后气泡消失
C.读数时滴定前仰视,滴定后俯视
D.锥形瓶中残留少量水
④计算样品中Na2C2O4的纯度67%.
分析 (1)①根据草酸和碳酸的电离平衡常数判断酸性强弱,然后利用强酸置换弱酸的原理进行判断;
②A.溶液显示酸性,说明草酸的电离程度大于草酸氢根离子;
B.根据溶液中的电荷守恒判断;
C.根据溶液显示酸性分析;
D.根据溶液中的物料守恒判断;
(2)①根据酸性高锰酸钾溶液为酸性、具有强氧化性分析;
②根据滴定结束前为无色,滴定结束后为紫色判断滴定终点;
③发生反应为2MnO4-+5C2O42-+16H+=10CO2↑+2Mn2++8H2O,根据滴定操作对c=$\frac{c(标准)×V(标准)}{V(标准)}$的影响分析;
④先计算出20mL样品溶液消耗高锰酸钾的物质的量,再计算出100mL样品溶液消耗高锰酸钾的物质的量,然后根据反应计算出消耗草酸钠的物质的量,根据m=nM计算出1g草酸钠样品中含有草酸钠的质量,最后计算出样品的纯度.
解答 解:(1)根据25℃H2C2O4 K1=5.4×10-2、K2=5.4×10-5,H2CO3 K1=4.5×10-7、K2=4.7×10-11可知酸性大小为:H2C2O4>HC2O4->H2CO3>HCO3-,
①A.酸性HC2O4->H2CO3,则草酸与碳酸根离子反应生成二氧化碳气体和草酸根离子,正确的反应为:H2C2O4+CO32-=CO2↑+H2O+C2O42-,故A错误;
B.HC2O4->H2CO3>HCO3-,草酸氢根离子少量时,发生反应:HC2O4-+CO32-=HCO3-+C2O42-,故B正确;
C.酸性HC2O4->H2CO3,草酸与碳酸根离子反应生成二氧化碳气体和草酸根离子:H2O+CO2+C2O42-?=HC2O4-?+HCO3-不会反应,故错误;
D.酸性HC2O4->H2CO3,碳酸无法置换出草酸氢根离子,该反应C2O42-+CO2+H2O═H2C2O4+CO32-不会发生,故D错误;
故答案为:B;
②向1L 0.02mol/L H2C2O4溶液中滴加1L 0.01mol/L NaOH溶液,反应后溶质为等浓度的H2C2O4和NaHC2O4,混合溶液中c(H+)>c(OH-),
A.草酸的电离程度大于HC2O4-的电离,则溶液中c(H2C2O4)<c(HC2O4-),故A错误;
B.根据电荷守恒可得:c(Na+)+c(H+)═2c(C2O42-)+c(HC2O4-)+c(OH-),故B正确;
C.溶液呈酸性:c(OH-)<c(H+),则c(OH-)<c(H+)+2c(H2C2O4)+c(HC2O4-),故C错误;
D.根据物料守恒可得:c(H2C2O4)+c(C2O42-)+c(HC2O4-)=0.01mol/L,故D错误;
故答案为:B;
(2)①酸性高锰酸钾溶液呈酸性,且具有强氧化性,能够氧化碱式滴定管的橡胶管,所以应该用酸式滴定管量取,
故答案为:酸式;
②滴定结束前溶液为无色,滴定结束后溶液层紫色,所以滴定终点的现象为:无色变为紫色(紫红色),且半分钟内不褪色,
故答案为:无色变为紫色(紫红色),且半分钟内不褪色;
③A.盛装的Na2C2O4的滴定管没润洗,导致待测液浓度减小,则测定结果偏小,故A错误;
B.盛装高锰酸钾溶液的滴定管滴定前尖嘴处有气泡,滴定后气泡消失,导致消耗的标准液体积偏大,测定结果偏高,故B正确;
C.读数时滴定前仰视,滴定后俯视,读出的高锰酸钾溶液体积偏小,测定结果偏低,故C错误;
D.锥形瓶中残留少量水,对测定结果无影响,故D错误;
故答案为:B;
④25.00mL 0.016mol/L高锰酸钾溶液中含有高锰酸钾的物质的量为:0.016mol/L×0.025L=0.0004mol,100mL该样品溶液完全反应消耗高锰酸钾的物质的量为:0.0004mol×$\frac{100mL}{20mL}$=0.002mol,根据反应2MnO4-+5C2O42-+16H+=10CO2↑+2Mn2++8H2O可知,1gNa2C2O4固体样品中含有草酸钠的物质的量为:0.002mol×$\frac{5}{2}$=0.005mol,质量为:134g/mol×0.005mol=0.67g,
所以Na2C2O4的纯度为:$\frac{0.67g}{1g}$×100%=67%,
故答案为:67%.
点评 本题考查了探究物质组成方法,题目难度中等,涉及中和滴定、离子浓度大小比较、溶液酸性强弱比较等知识,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及灵活应用能力.

| A. | 60s内以X浓度变化表示的反应速率为0.001 mol/(L•s) | |
| B. | 将容器体积变为20L,Z的平衡浓度变为原来的$\frac{1}{2}$ | |
| C. | 若增大压强,则物质Y的转化率减小 | |
| D. | 若升高温度,X的体积分数增大,则该反应的正反应为吸热反应 |
| 元素代号 | 相关信息 |
| A | A的单质能与冷水剧烈反应,得到强碱性溶液 |
| B | B的原子最外层电子数是其内层电子数的三倍 |
| C | 是地壳中含量最高的金属元素 |
| D | A、B、D组成的化合物X是84消毒剂的主要成分 |
| E | 所有有机物中都含有E元素 |
 .
.(2)X的化学式为NaClO.
(3)A、B、D三种元素形成的简单离子半径由大到小的顺序为Cl->O2->Na+(用离子符号表示).
(4)A、B形成的一种原子个数比为1:1化合物的化学式为Na2O2.
(5)A在真空高压下能与由元素D、E组成化合物ED4反应生成两种固体物质,其中一种是自然界中硬度最大的物质,此反应在科学上有“稻草变黄金”的美称.写出该反应的化学方程式4Na+CCl4$\frac{\underline{\;真空高压\;}}{\;}$4NaCl+C.
| A. | NaOH | B. | Ca(OH)2 | C. | Mg(OH)2 | D. | Al(OH)3 |
| A. | 质量数 | B. | 中子数 | ||
| C. | 次外层电子数 | D. | 电子层数和最外层电子数 |
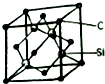 铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.请回答:
铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.请回答: .
. 甲醇是一种重要的化工原料,有着重要的用途和应用前景.
甲醇是一种重要的化工原料,有着重要的用途和应用前景.