题目内容
已知4n mol NH3与5n mol O2恰好完全反应生成6n mol 水和4n mol物质A,则A的化学式为( )
| A、N2 |
| B、NO |
| C、NO2 |
| D、HNO3 |
考点:化学方程式的有关计算
专题:计算题
分析:在化学反应中,各物质的物质的量之比等于各物质的计量系数比,根据原子守恒来解决.
解答:
解:各物质的物质的量之比=各物质的计量系数比=4n:5n:6n:4n=4:5:6:4,所以反应表达为:4NH3+5O2=6H2O+4A,
根据原子个数守恒,反应前原子的种类和数目分别是:氮原子4个,氧原子10个、氢原子12个;反应后原子的种类和数目分别是:氧原子6个,氮原子0个、氢原子12个;因此反应前后相差的原子种类和数目分别是:氧原子4个,氮原子4个,所以一个A分子是有1个氮原子和1个氧原子组成的,即A的分子式为NO,
故选B.
根据原子个数守恒,反应前原子的种类和数目分别是:氮原子4个,氧原子10个、氢原子12个;反应后原子的种类和数目分别是:氧原子6个,氮原子0个、氢原子12个;因此反应前后相差的原子种类和数目分别是:氧原子4个,氮原子4个,所以一个A分子是有1个氮原子和1个氧原子组成的,即A的分子式为NO,
故选B.
点评:本题考查学生在化学反应中各物质的物质的量之比等于各物质的计量系数比之一结论以及原子守恒思想在反应中的应用知识,题目较简单,学会利用质量守恒定律计算某种物质的分子式的方法,注意物质在化学方程式中的系数.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
Na2O2、HCl、Na2SO3三种物质在水中完全反应后,溶液恰好呈中性,且反应过程中无气体放出,则Na2O2、HCl、Na2SO3的物质的量之比可能为( )
| A、2:3:2 |
| B、1:2:1 |
| C、2:3:1 |
| D、4:2:1 |
下列说法正确的是( )
| A、强电解质一定含金属阳离子,弱电解质一定不含金属元素 |
| B、强电解质溶液的导电性不一定比弱电解质的导电性强 |
| C、SO3溶于水后导电性很强,所以SO3是强电解质 |
| D、强电解质是易溶化合物,弱电解质是难溶化合物 |
下列各组中的离子,能在溶液中大量共存的是( )
| A、Na+、Mg2+、SO42-、Cl- |
| B、Na+、Ca2+、CO32-、NO3- |
| C、Na+、H+、Cl-、CO32- |
| D、K+、Fe3+、SO42-、OH- |
下列实验操作或结论正确的是( )
| A、配制一定物质的量浓度的溶液时,容量瓶必须洁净、干燥,不漏水 |
| B、实验室里需要480mL2.0moI?L-1氢氧化钠溶液,配制溶液时先称量氢氧化钠固体38.4g,然后再按照溶解、冷却、洗涤、定容、摇匀的步骤进行操作 |
| C、25℃时,用惰性电极电解某浓度的NaOH溶液,一小段时间后,NaOH溶液的浓度可能增大,也可能不变 |
| D、K2CO3在酒精灯上灼烧时能直接观察到紫色火焰 |
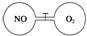 如图所示,两个连通容器用活塞分开,左右两室(体积相同)各充入一定量NO和O2,且恰好使两容器内气体密度相同.打开活塞,使NO与O2充分反应.(已知2NO+O2═2NO2)
如图所示,两个连通容器用活塞分开,左右两室(体积相同)各充入一定量NO和O2,且恰好使两容器内气体密度相同.打开活塞,使NO与O2充分反应.(已知2NO+O2═2NO2)