题目内容
Na2O2、HCl、Na2SO3三种物质在水中完全反应后,溶液恰好呈中性,且反应过程中无气体放出,则Na2O2、HCl、Na2SO3的物质的量之比可能为( )
| A、2:3:2 |
| B、1:2:1 |
| C、2:3:1 |
| D、4:2:1 |
考点:氧化还原反应的计算
专题:
分析:溶液恰好呈中性,且反应过程中无气体放出,则发生2Na2O2+2H2O=4NaOH+O2↑、O2+Na2SO3=2Na2SO4、4NaOH+4HCl=4NaCl+4H2O,以此来解答.
解答:
解:溶液恰好呈中性,且反应过程中无气体放出,则发生2Na2O2+2H2O=4NaOH+O2↑、O2+2Na2SO3=2Na2SO4、4NaOH+4HCl=4NaCl+4H2O,
设过氧化钠为2mol,则生成4molNaOH与1molO2,能恰好与4molHCl、2molNa2SO3反应,溶液为中性,
则Na2O2、HCl、Na2SO3的物质的量之比可能为2mol:4mol:2mol=1:2:1,
故选B.
设过氧化钠为2mol,则生成4molNaOH与1molO2,能恰好与4molHCl、2molNa2SO3反应,溶液为中性,
则Na2O2、HCl、Na2SO3的物质的量之比可能为2mol:4mol:2mol=1:2:1,
故选B.
点评:本题考查氧化还原反应的计算,为高频考点,把握发生的反应及物质的量关系为解答的关键,注意无气体放出发生的氧化还原反应为解答的难点,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
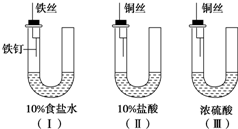 某学生为研究金属腐蚀的条件,用金属丝将三根大小相同的铁钉分别固定在如图所示的三个装置中,放置一星期后观察现象,下列描述错误的是( )
某学生为研究金属腐蚀的条件,用金属丝将三根大小相同的铁钉分别固定在如图所示的三个装置中,放置一星期后观察现象,下列描述错误的是( )| A、装置Ⅰ的U形管铁钉一侧的液面一定会上升 |
| B、装置Ⅱ中的铁钉腐蚀最严重 |
| C、比较U形管铁钉一侧的液面:装置Ⅰ比装置Ⅱ的低 |
| D、装置Ⅲ中的铁钉几乎没有被腐蚀 |
下列说法正确的是( )
| A、S在纯氧中燃烧可生成SO3 |
| B、用澄清石灰水可鉴别CO2和SO2 |
| C、SO2能使KMnO4溶液褪色 |
| D、CO2通入CaCl2溶液中能产生白色沉淀 |
某溶液中有Cu2+、Al3+、SO42-和M离子,其物质的量之比为2:1:3:1,则M可能是( )
| A、Na+ |
| B、H+ |
| C、Cl- |
| D、OH- |
已知4n mol NH3与5n mol O2恰好完全反应生成6n mol 水和4n mol物质A,则A的化学式为( )
| A、N2 |
| B、NO |
| C、NO2 |
| D、HNO3 |
实验室用Al2(SO4)3制取Al(OH)3,最适合的试剂是( )
| A、NH3?H2O |
| B、NaOH |
| C、H2SO4 |
| D、KOH |