题目内容
根据题目要求作答:
(1)下列曲线表示卤族元素某种性质随核电荷数递增的变化趋势,正确的是

(2)下列物质变化,只与范德华力有关的是
A.干冰熔化 B.冰的汽化 C.乙醇与水混溶 D.碘溶于四氯化碳 E.石英熔融
(3)已知0.1mol CrCl3?6H2O在水溶液中用过量硝酸银溶液处理,产生0.2mol AgCl沉淀.此配合物最有可能的化学式是 .
A.[Cr(H2O)6]Cl3 B.[Cr(H2O)5Cl]Cl2?H2O
C.[Cr(H2O)4Cl2]Cl?2H2O D.[Cr(H2O)3Cl3]?3H2O
(4)金属镍在电池、合金、催化剂等方面应用广泛.Ni是元素周期表中第28号元素.
①第2周期基态原子未成对电子数与Ni相同且电负性最小的元素是 ;
②NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点NiO FeO(填“<”或“>”);
③CO与N2结构相似CO分子内σ键与π键个数之比为 .Ni、Fe、Co等金属都能与CO反应形成混合物,Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于 (填晶体类型).
④普鲁士蓝是一种配合物,可用作燃料,它的晶胞结构如图所示(其中K+在体心位置,未标出),普鲁士蓝中n(Fe3+):n(CN)= .

(1)下列曲线表示卤族元素某种性质随核电荷数递增的变化趋势,正确的是

(2)下列物质变化,只与范德华力有关的是
A.干冰熔化 B.冰的汽化 C.乙醇与水混溶 D.碘溶于四氯化碳 E.石英熔融
(3)已知0.1mol CrCl3?6H2O在水溶液中用过量硝酸银溶液处理,产生0.2mol AgCl沉淀.此配合物最有可能的化学式是
A.[Cr(H2O)6]Cl3 B.[Cr(H2O)5Cl]Cl2?H2O
C.[Cr(H2O)4Cl2]Cl?2H2O D.[Cr(H2O)3Cl3]?3H2O
(4)金属镍在电池、合金、催化剂等方面应用广泛.Ni是元素周期表中第28号元素.
①第2周期基态原子未成对电子数与Ni相同且电负性最小的元素是
②NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点NiO
③CO与N2结构相似CO分子内σ键与π键个数之比为
④普鲁士蓝是一种配合物,可用作燃料,它的晶胞结构如图所示(其中K+在体心位置,未标出),普鲁士蓝中n(Fe3+):n(CN)=

考点:配合物的成键情况,同一主族内元素性质递变规律与原子结构的关系,元素电离能、电负性的含义及应用,用晶格能的大小衡量离子晶体中离子键的强弱,晶胞的计算
专题:
分析:(1)a.第VIIA族元素中,元素的电负性随着原子序数的增大而减小;
b.F元素没有正化合价;
c.第VIIA族氢化物的沸点与其相对分子质量成正比,氢键的存在导致氢化物的沸点升高;
d.卤族单质的熔点随着核电荷数的增大而增大;
(2)分子晶体中分子之间存在范德华力,范德华力与分子晶体的熔沸点、硬度有关,注意范德华力与氢键、化学键的区别;
(3)氯化铬(CrCl3?6H2O)中的阴离子氯离子能和银离子反应生成氯化银沉淀,注意配体中的氯原子不能和银离子反应,根据氯化铬(CrCl3?6H2O)和氯化银物质的量的关系式计算氯离子个数,从而确定氯化铬(CrCl3?6H2O)的化学式;
(4)①Ni的外围电子排布为3d84s2,3d能级上有2个未成对电子;
②离子晶体的熔点与离子键的强弱有关,离子所带电荷数越多,离子半径越小,离子键越强,熔点越高;
③CO与氮气互为等电子体,故CO中C与O原子之间形成三键;Fe(CO)5常温下呈液态,熔沸点较低,应为分子晶体;
④利用均摊法计算以及电荷守恒来分析.
b.F元素没有正化合价;
c.第VIIA族氢化物的沸点与其相对分子质量成正比,氢键的存在导致氢化物的沸点升高;
d.卤族单质的熔点随着核电荷数的增大而增大;
(2)分子晶体中分子之间存在范德华力,范德华力与分子晶体的熔沸点、硬度有关,注意范德华力与氢键、化学键的区别;
(3)氯化铬(CrCl3?6H2O)中的阴离子氯离子能和银离子反应生成氯化银沉淀,注意配体中的氯原子不能和银离子反应,根据氯化铬(CrCl3?6H2O)和氯化银物质的量的关系式计算氯离子个数,从而确定氯化铬(CrCl3?6H2O)的化学式;
(4)①Ni的外围电子排布为3d84s2,3d能级上有2个未成对电子;
②离子晶体的熔点与离子键的强弱有关,离子所带电荷数越多,离子半径越小,离子键越强,熔点越高;
③CO与氮气互为等电子体,故CO中C与O原子之间形成三键;Fe(CO)5常温下呈液态,熔沸点较低,应为分子晶体;
④利用均摊法计算以及电荷守恒来分析.
解答:
解:(1)a.同一主族中,元素的电负性随着原子序数的增大而减小,所以从氟到溴,其电负性逐渐减小,故正确;
b.氟元素没有正化合价,第VIIA族氯、溴元素的最高化合价数值等于其族序数,故错误;
c.第VIIA族元素氢化物的沸点随着相对分子质量的增大而增大,但HF分子间能形成氢键,氢键属于特殊的分子间作用力,强度大于分子间作用力,沸点最高,故错误;
d.由于卤族元素的单质均属于分子晶体,随相对分子质量增大范德华力增大,因而沸点逐渐升高,故错误;
故答案为:a;
(2)A.干冰属于分子晶体,熔化时克服范德华力,故A正确;
B.冰气化时克服氢键和范德华力,故B错误;
C.乙醇分子间含有氢键,与水混溶克服氢键和范德华力,故C错误;
D.碘属于分子晶体,溶于四氯化碳只克服范德华力,故D正确;
E.石英的主要成分为二氧化硅,属于原子晶体,熔融时克服共价键,故E错误.
故答案为:AD;
(3)氯化铬(CrCl3?6H2O)和氯化银的物质的量之比是1:2,根据氯离子守恒知,一个氯化铬(CrCl3?6H2O)化学式中含有2个氯离子,剩余的1个氯离子是配原子,所以氯化铬(CrCl3?6H2O)的化学式可能为[Cr(H2O)5Cl]Cl2?H2O,
故答案为:B;
(4)①Ni的外围电子排布为3d84s2,3d能级上有2个未成对电子.第二周期中未成对电子数为2的元素有C、O,其中C的电负性小,故答案为:C;
②Ni0、Fe0的晶体结构类型均与氯化钠的相同,说明二者都是离子晶体,离子晶体的熔点与离子键的强弱有关,离子所带电荷数越多,离子半径越小,离子键越强,熔点越高.由于Ni2+的离子半径小于Fe2+的离子半径,属于熔点是NiO>FeO,故答案为:>;
③CO与氮气互为等电子体,故CO中C与O原子之间形成三键,分子中σ键与π键的数目比为1:2,Fe(CO)5常温下呈液态,熔沸点较低,易溶于非极性溶剂,应为分子晶体,
故答案为:1:2;分子晶体;
④Fe3+离子的个数为:4×
=
;CN-离子的个数为:12×
=3,n(Fe3+):n(CN一)=1:6,故答案为:1:6.
b.氟元素没有正化合价,第VIIA族氯、溴元素的最高化合价数值等于其族序数,故错误;
c.第VIIA族元素氢化物的沸点随着相对分子质量的增大而增大,但HF分子间能形成氢键,氢键属于特殊的分子间作用力,强度大于分子间作用力,沸点最高,故错误;
d.由于卤族元素的单质均属于分子晶体,随相对分子质量增大范德华力增大,因而沸点逐渐升高,故错误;
故答案为:a;
(2)A.干冰属于分子晶体,熔化时克服范德华力,故A正确;
B.冰气化时克服氢键和范德华力,故B错误;
C.乙醇分子间含有氢键,与水混溶克服氢键和范德华力,故C错误;
D.碘属于分子晶体,溶于四氯化碳只克服范德华力,故D正确;
E.石英的主要成分为二氧化硅,属于原子晶体,熔融时克服共价键,故E错误.
故答案为:AD;
(3)氯化铬(CrCl3?6H2O)和氯化银的物质的量之比是1:2,根据氯离子守恒知,一个氯化铬(CrCl3?6H2O)化学式中含有2个氯离子,剩余的1个氯离子是配原子,所以氯化铬(CrCl3?6H2O)的化学式可能为[Cr(H2O)5Cl]Cl2?H2O,
故答案为:B;
(4)①Ni的外围电子排布为3d84s2,3d能级上有2个未成对电子.第二周期中未成对电子数为2的元素有C、O,其中C的电负性小,故答案为:C;
②Ni0、Fe0的晶体结构类型均与氯化钠的相同,说明二者都是离子晶体,离子晶体的熔点与离子键的强弱有关,离子所带电荷数越多,离子半径越小,离子键越强,熔点越高.由于Ni2+的离子半径小于Fe2+的离子半径,属于熔点是NiO>FeO,故答案为:>;
③CO与氮气互为等电子体,故CO中C与O原子之间形成三键,分子中σ键与π键的数目比为1:2,Fe(CO)5常温下呈液态,熔沸点较低,易溶于非极性溶剂,应为分子晶体,
故答案为:1:2;分子晶体;
④Fe3+离子的个数为:4×
| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 4 |
点评:本题主要考查元素电负性、晶体微粒间作用力、配位键、晶体性质、晶胞计算、等电子体的运用等,是对知识与能力综合考查,难度较大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
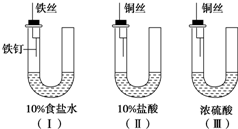 某学生为研究金属腐蚀的条件,用金属丝将三根大小相同的铁钉分别固定在如图所示的三个装置中,放置一星期后观察现象,下列描述错误的是( )
某学生为研究金属腐蚀的条件,用金属丝将三根大小相同的铁钉分别固定在如图所示的三个装置中,放置一星期后观察现象,下列描述错误的是( )| A、装置Ⅰ的U形管铁钉一侧的液面一定会上升 |
| B、装置Ⅱ中的铁钉腐蚀最严重 |
| C、比较U形管铁钉一侧的液面:装置Ⅰ比装置Ⅱ的低 |
| D、装置Ⅲ中的铁钉几乎没有被腐蚀 |
某溶液中有Cu2+、Al3+、SO42-和M离子,其物质的量之比为2:1:3:1,则M可能是( )
| A、Na+ |
| B、H+ |
| C、Cl- |
| D、OH- |
已知4n mol NH3与5n mol O2恰好完全反应生成6n mol 水和4n mol物质A,则A的化学式为( )
| A、N2 |
| B、NO |
| C、NO2 |
| D、HNO3 |
实验室用Al2(SO4)3制取Al(OH)3,最适合的试剂是( )
| A、NH3?H2O |
| B、NaOH |
| C、H2SO4 |
| D、KOH |
下列四类反应:①置换反应 ②复分解反应 ③只有一种元素化合价发生变化的反应 ④离子反应,其中一定不是氧化还原反应的是( )
| A、只有② | B、只有③ |
| C、只有②④ | D、①②③④ |
 利用如图所示装置测定中和热的实验步骤如下:
利用如图所示装置测定中和热的实验步骤如下: