题目内容
20.某中学化学研究性学习小组利用以下装置制取并探究氨气的性质.(1)A中发生反应的化学方程式为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O .
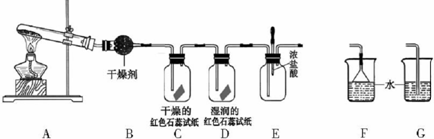
(2)实验室收集氨气的方法是向下排空气法.为防止过量氨气造成空气污染,需要在上述装置的末端增加一个尾气处理装置,合适的装置是F(填“F”或“G”);
(3)C、D装置中颜色会发生变化的是D(填“C”或“D”),写出导致指示剂变色的有关化学方程式和电离方程式有关NH3+H2O=NH3•H2O、NH3•H2O?NH4++OH-.如果没有B装置,上述会发生颜色变化的是CD (填“C”或“D”).
(4)当实验进行一段时间后,挤压E装置中的胶头滴管,滴入1-2滴浓盐酸,可观察到的现象是有白烟生成,有关化学方程式是NH3+HCl=NH4Cl.
(5)某地发生氨气泄漏事件,500多居民深夜大转移.假如你在现场,你会采用什么自救方法?①用湿毛巾捂住口鼻,并迅速撤离.②低头弯腰,往低处跑,迅速撤离.③逆风奔跑,迅速撤离.④戴上防毒面具,迅速撤离.
分析 (1)根据A中发生反应的化学方程式可知,没有元素化合价的变化,不是氧化还原反应;
(2)氨气易溶于水,密度比空气小;因为氨气极易溶于水,所以吸收氨气时要用防倒吸装置;
(3)氨气能使湿润的红色石蕊试纸变蓝;氨气遇到湿润的红色石蕊试纸,会和水反应生成一水合氨,一水合氨电离出氢氧根离子显碱性;
(4)氨气与挥发的HCl会生成白烟;
(5)氨气是有刺激性气味的气体,比空气轻,易溶于水等性质分析选择自救的方法.
解答 解:(1)分析A中发生反应的化学方程式为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(2)氨气易溶于水,密度比空气小,所以用向下排空气法收集,因为氨气极易溶于水,所以吸收氨气时要用防倒吸装置,
故答案为:向下排空气法;F;
(3)氨气能使湿润的红色石蕊试纸变蓝,所以D中颜色发生变化,写出导致指示剂变色的原因是氨气遇到湿润的红色石蕊试纸,会和水反应生成一水合氨,一水合氨电离出氢氧根离子显碱性,有关化学方程式为:NH3+H2O=NH3•H2O,电离方程式NH3•H2O?NH4++OH-,如果没有B装置,氨气中含有水蒸气,遇到干燥石蕊试纸,湿润石蕊试纸都会变红色,所以上述会发生颜色变化的是CD,
故答案为:D;NH3+H2O=NH3•H2O;NH3•H2O?NH4++OH-;CD;
(4)氨气与挥发的HCl会生成氯化铵晶体,所以有白烟生产,反应的化学方程式为:NH3+HCl=NH4Cl,
故答案为:有白烟生成;NH3+HCl=NH4Cl;
(5)根据氨气易溶于水,气体易随风飘动等性质分析,可采取①用湿毛巾捂住口鼻,并迅速撤离.②低头弯腰,往低处跑,迅速撤离.③逆风奔跑,迅速撤离.④戴上防毒面具,迅速撤离,
故答案为:①用湿毛巾捂住口鼻,并迅速撤离.②低头弯腰,往低处跑,迅速撤离.③逆风奔跑,迅速撤离.④戴上防毒面具,迅速撤离.
点评 本题考查了氨气的制备及氨气的性质,题目难度中等,掌握物质性质和实验基本操作是解题关键.

| 选项 | 操作 | 结论 |
| A | 配制FeCl2溶液时加入适量的盐酸 | 抑制Fe2+水解 |
| B | 浓硫酸和蔗糖反应产生的气体通过足量的KMnO4溶液,气体全部被吸收且溶液紫红色褪去 | “黑面包实验”产生的气体具有还原性 |
| C | 制备乙酸乙酯的实验,将蒸出的乙酸乙酯蒸汽导在饱和的NaOH溶液液面以上 | 防止倒吸,便于分层. |
| D | 幼儿使用含NaF的牙膏,可以使牙齿上的Ca5(PO4)3OH转化为Ca5(PO4)3F,防止蛀牙 | Ksp[Ca5(PO4)3F]<Ksp[Ca5(PO4)3OH] |
| A. | A | B. | B | C. | C | D. | D |
| A. | Na2O、Na2O2组成元素相同,含有的阴、阳离子数目之比也相同 | |
| B. | 金属钠着火时,可用泡沫灭火器来灭火 | |
| C. | 钠与熔融的四氯化钛反应可制取钛 | |
| D. | 实验时用剩的钠块应该放回原试剂瓶 |
 的一氯取代物的种数是( )
的一氯取代物的种数是( )| A. | 2 | B. | 3 | C. | 4 | D. | 5 |
| A. | 1:1 | B. | 1:3 | C. | 2:3 | D. | 3:2 |
| A. |  | B. |  | C. | H2NCH2COONa | D. | H2NCH2COOH |
| A. | 除去N2中的少量O2:通过灼热的铜网,收集气体 | |
| B. | 除 CO2中的少量HCl:通入饱和Na2CO3溶液,收集气体 | |
| C. | 除去FeCl3溶液中的少量FeCl2:加入足量铁屑,充分反应后过滤 | |
| D. | 除去NaCl溶液中的少量AlCl3:加入适量氨水,过滤 |