题目内容
12.电镀含铬废水的处理方法较多.Ⅰ.某工业废水中主要含有Cr3+,同时还含有少量的Cu2+、Fe2+、Fe3+和Al3+等,且酸性较强.为回收利用,通常采用如图流程处理:
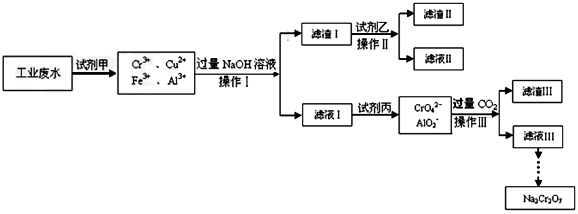
已知:(1)Cr(OH)3与Al(OH)3性质相似,为两性氢氧化物;Cr(OH)3→NaCrO2→Na2CrO4→Na2Cr2O7
(2)Cu(OH)2能溶于氨水:Cu(OH)2+4NH3•H2O═[Cu(NH3)4]2++2OH-+4H2O
请回答:
(1)操作Ⅰ的名称过滤,上述操作Ⅰ、Ⅱ、Ⅲ相同,进行该实验操作所需要的主要玻璃仪器除烧杯、漏斗外,还有玻璃棒.
(2)滤渣Ⅰ的主要成分为Cu(OH)2、Fe(OH)3 (写化学式),试剂乙的名称氨水.
(3)加入试剂甲的目的将Fe2+氧化成Fe3+.
(4)废水处理流程中生成滤渣Ⅲ的离子方程式2H2O+A1O2-+CO2=Al(OH)3↓+HCO3-.
Ⅱ.酸性条件下,六价铬主要以Cr2O72-形式存在.工业上用以下方法处理处理含Cr2O72-的废水:
①往废水中加入适量的NaCl,搅拌均匀;
②用Fe为电极进行电解,经过一段时间,最后有Cr(OH)3和Fe(OH)3沉淀产生;
③过滤回收沉淀,废水达到排放标准.
(5)电解时能否用Cu电极来代替Fe电极不能(填“能”或“不能”),理由因阳极产生的Cu2+不能使Cr2O72-还原到低价态.
分析 I.工业废水中含有Cr3+,同时还含有少量的Cu2+、Fe2+、Fe3+和Al3+等,且酸性较强,根据流程图知,工业废水中加入试剂甲后溶液中没有Fe2+,说明废水中的Fe2+被氧化生成Fe3+,甲应该具有强氧化性,且不能引进杂质,则试剂甲为双氧水;向溶液中加入过量NaOH溶液,Cu2+、Fe3+都转化为氢氧化物沉淀,根据题给信息(1)知,Al3+、Cr3+和过量NaOH反应生成可溶性的钠盐,然后采用过滤方法得到滤渣I、滤液I,滤渣I为Cu(OH)2、Fe(OH)3,滤液I中含有NaAlO2、NaCrO2、NaOH;
向滤渣I中加入试剂乙,然后过滤,得到滤渣II和滤液II,根据题给信息(2)知,试剂乙为氨水,滤渣II为Fe(OH)3,滤液II为[Cu(NH3)4](OH)2;
向滤液I中加入试剂丙得到AlO2-和CrO42-,根据题给信息(1)知,试剂丙可以将CrO2-氧化为CrO42-,实现三价铬到CrO42-的转化,且不能引进杂质,所以试剂丙是氯气,向溶液中通入过量二氧化碳,得到沉淀IIIAl(OH)3 和滤液III,滤液III最终得到Na2Cr2O7;
(1)分离难溶性固体和溶液采用过滤方法;进行该实验操作所需要的主要玻璃仪器除烧杯、漏斗外,还有玻璃棒;
(2)滤渣I的主要成分为Cu(OH)2、Fe(OH)3,试剂乙的名称氨水;
(3)加入试剂甲的目的是将亚铁离子氧化为铁离子;
(4)废水处理流程中生成滤渣III的离子方程式为2H2O+A1O2-+CO2=Al(OH)3↓+HCO3-;
II.(5)用Fe为电极进行电解生成Fe2+,作为还原剂还原Cr2O72-,而铜电极作阳极生成Cu2+不能还原Cr2O72-.
解答 解:I.工业废水中含有Cr3+,同时还含有少量的Cu2+、Fe2+、Fe3+和Al3+等,且酸性较强,根据流程图知,工业废水中加入试剂甲后溶液中没有Fe2+,说明废水中的Fe2+被氧化生成Fe3+,甲应该具有强氧化性,且不能引进杂质,则试剂甲为双氧水;向溶液中加入过量NaOH溶液,Cu2+、Fe3+都转化为氢氧化物沉淀,根据题给信息(1)知,Al3+、Cr3+和过量NaOH反应生成可溶性的钠盐,然后采用过滤方法得到滤渣I、滤液I,滤渣I为Cu(OH)2、Fe(OH)3,滤液I中含有NaAlO2、NaCrO2、NaOH;
向滤渣I中加入试剂乙,然后过滤,得到滤渣II和滤液II,根据题给信息(2)知,试剂乙为氨水,滤渣II为Fe(OH)3,滤液II为[Cu(NH3)4](OH)2;
向滤液I中加入试剂丙得到AlO2-和CrO42-,根据题给信息(1)知,试剂丙可以将CrO2-氧化为CrO42-,实现三价铬到CrO42-的转化,且不能引进杂质,所以试剂丙是氯气,向溶液中通入过量二氧化碳,得到沉淀IIIAl(OH)3 和滤液III,滤液III最终得到Na2Cr2O7;
(1)分离难溶性固体和溶液采用过滤方法,所以操作I名称是过滤;进行该实验操作所需要的主要玻璃仪器除烧杯、漏斗外,还有玻璃棒,
故答案为:过滤;玻璃棒;
(2)通过以上分析知,滤渣I的主要成分为Cu(OH)2、Fe(OH)3,试剂乙的名称氨水,
故答案为:Cu(OH)2、Fe(OH)3;氨水;
(3)在电镀铬的工业废水中主要含有Cr3+,同时还含有少量的Cu2+、Fe2+ Fe3+和Al3+等,加入试剂甲以后废水的成分含有Cr3+、Cu2+、Fe3+和Al3+,由此可见试剂甲将亚铁离子氧化为三价铁离子,
故答案为:将Fe2+氧化成Fe3+;
(4)偏铝酸钠和过量二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠,所以废水处理流程中生成滤渣III的离子方程式为2H2O+A1O2-+CO2=Al(OH)3↓+HCO3-,
故答案为:2H2O+A1O2-+CO2=Al(OH)3↓+HCO3-;
II.(5)用Fe为电极进行电解生成Fe2+,作为还原剂还原Cr2O72-,而铜电极作阳极生成Cu2+不能还原Cr2O72-,故不用Cu电极来代替Fe电极,
故答案为:不能;因阳极产生的Cu2+不能使Cr2O72-还原到低价态.
点评 本题考查物质的分离和提纯,为高频考点,涉及实验基本操作、氧化还原反应、电解原理等知识点,明确流程图中化学反应原理、基本操作方法是解本题关键,难点是(5)题电解原理,题目难度中等.

| A. | 标准状况下,22.4 L由H2和O2组成的混合气体,所含分子总数为NA | |
| B. | 1mol Cl2参加反应,转移的电子数一定为2NA | |
| C. | 常温常压下,1 mol氖气含有的原子数为NA | |
| D. | 1L1 mol.L-l FeCl3溶液中Fe3+的数目小于NA |
| A. | Cl2 | B. | KMnO4 | C. | HCl | D. | FeCl3 |
| A. | 放电时,电池的负极反应为LiC6-e-═Li++C6 | |
| B. | 充电时,电池的正极反应为CoO2+Li++e-═LiCoO2 | |
| C. | 羧酸、醇等含活泼氢的有机物可用作锂离子电池的电解质 | |
| D. | 锂离子电池的比能量(单位质量释放的能量)低 |
 Na、Al、Fe、Cu是中学化学中重要的金属元素,它们的单质及其化合物之间有很多转化关系,如通常所说的“铁三角”、“铝三角”等.如表所列物质不能按如图(“→”表示一步完成)关系相互转化的是( )
Na、Al、Fe、Cu是中学化学中重要的金属元素,它们的单质及其化合物之间有很多转化关系,如通常所说的“铁三角”、“铝三角”等.如表所列物质不能按如图(“→”表示一步完成)关系相互转化的是( )| 选项 | A | B | C | D |
| a | NaOH | Al | Fe | Cu |
| b | Na | Al2O3 | FeCl3 | CuSO4 |
| c | NaCl | Al(OH)3 | FeCl2 | CuCl2 |
| A. | A | B. | B | C. | C | D. | D |
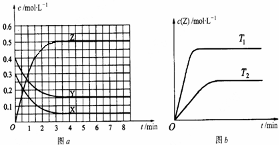
| A. | 该反应的正反应是放热反应 | |
| B. | T0时,该反应的平衡常数为$\frac{1}{3}$ | |
| C. | 反应时各物质的反应速率关系为:2v (X)=2v (Y)=v (Z) | |
| D. | 图a中反应达到平衡时,Y的转化率为37.5% |
 [Al(OH)2]++H+.
[Al(OH)2]++H+.
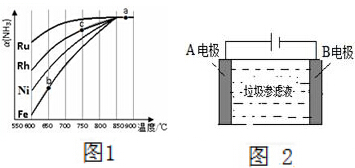 氨气在生产、生活和科研中应用十分广泛.
氨气在生产、生活和科研中应用十分广泛.