题目内容
15. 已知A、B、C、D、E、F、G七种元素,它们的原子序数依次增大.A在所有元素中原子半径最小;B原子核外电子有6种不同运动状态;D与C、E均相邻;A、D、E三种元素的原子序数之和为25;E2-和F+有相同的核外电子排布;G的质子数是25.请回答下列问题:
已知A、B、C、D、E、F、G七种元素,它们的原子序数依次增大.A在所有元素中原子半径最小;B原子核外电子有6种不同运动状态;D与C、E均相邻;A、D、E三种元素的原子序数之和为25;E2-和F+有相同的核外电子排布;G的质子数是25.请回答下列问题:(1)写出元素G的基态原子外围电子排布式3d54s2;B、C、D三种元素分别形成的最简单氢化物的沸点最高的是H2O(用化学式表示).
(2)由上述元素中的两种元素组成的一种阴离子与D的一种同素异形体分子互为等电子体,该阴离子化学式为NO2-.
(3)由上述元素组成的属于非极性分子且VSEPR为直线形的微粒的电子式
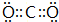 或
或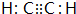 (任写一种).
(任写一种).(4)M是由4个C原子组成的一种不稳定的多原子单质分子,M分子中C原子杂化方式为sp3杂化,M分子的立体构型为正四面体.
(5)某一次性电池的比能量和可储存时间均比普通干电池优良,适用于大电流和连续放电,是民用电池的升级换代产品之一,它的负极材料是Zn,正极材料是G的一种常见氧化物,电解质是KOH.该电池的正极反应式为MnO2+e-+H2O═MnOOH+OH-.
(6)由上述元素中电负性最大的元素和第一电离能最小的元素形成的某化合物N的晶胞如图所示.化合物N与氧化钙相比,晶格能较小的是K2O(填化学式).已知该化合物的晶胞边长为a pm,则该化合物的密度为$\frac{94×4}{{N}_{A}×(a×1{0}^{-10})^{3}}$g•cm-3(只要求列出算式,不必计算出数值,阿伏加德罗常数的数值为NA,1pm=10-10cm).
分析 A、B、C、D、E、F、G七种元素,它们的原子序数依次增大.A在所有元素中原子半径最小,则A为H元素;B原子核外电子有6种不同运动状态,则B为碳元素;A、D、E三种元素的原子序数之和为25,则D、E原子序数之和25-1=24,D与C、E均相邻,由原子序数奇偶性可知D、E不能同周期,故二者同族,不能是三、四周期元素,因为同族相邻原子序数之和最小为11+19=30,可推知D为O元素、E为S元素,则C为N元素;G的质子数是25,则G为Mn;E2-和F+有相同的核外电子排布,则E为S元素、F为K元素.
解答 解:A、B、C、D、E、F、G七种元素,它们的原子序数依次增大.A在所有元素中原子半径最小,则A为H元素;B原子核外电子有6种不同运动状态,则B为碳元素;A、D、E三种元素的原子序数之和为25,则D、E原子序数之和25-1=24,D与C、E均相邻,由原子序数奇偶性可知D、E不能同周期,故二者同族,不能是三、四周期元素,因为同族相邻原子序数之和最小为11+19=30,可推知D为O元素、E为S元素,则C为N元素;G的质子数是25,则G为Mn;E2-和F+有相同的核外电子排布,则E为S元素、F为K元素.
(1)G的质子数是25,外围电子排布式为:3d54s2,B、C、D三种元素分别形成的最简单氢化物分别为甲烷、氨气、水,常温下水为液态,而甲烷、氨气为气态,故水的沸点最高,
故答案为:3d54s2;H2O;
(2)氧元素的同素异形体有O2、O3,由上述元素中的两种元素组成的一种阴离子与D的一种同素异形体分子互为等电子体,该阴离子化学式为NO2-,
故答案为:NO2-;
(3)由上述元素组成的属于非极性分子且VSEPR为直线形的微粒有CO2、C2H2,电子式为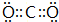 、
、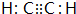 ,
,
故答案为: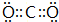 或
或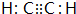 ;
;
(4)M是由4个N原子组成的一种不稳定的多原子单质分子,M分子中N原子杂化方式为sp3杂化,类似白磷的结构,即M分子的立体构型为正四面体,
故答案为:正四面体;
(5)某一次性电池的负极材料是Zn,正极材料是G的一种常见氧化物(MnO2),电解质是KOH.该电池的正极反应式为:MnO2+e-+H2O═MnOOH+OH-,
故答案为:MnO2+e-+H2O═MnOOH+OH-;
(6)电负性最大的元素是O元素,第一电离能最小的元素是K元素,该晶胞中白色球个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,黑色球个数=8,所以黑色和白色球个数之比为2:1,其化学式为K2O,离子晶体中晶格能与电荷成正比、与离子半径成正比,钙离子电荷数大于钾离子、半径小于钾离子,所以晶格能较小的是K2O,
所以白色球表示氧离子、黑色球表示钾离子,晶胞质量为4×$\frac{39×2+16}{{N}_{A}}$g,晶胞的边长为a×10-10cm,晶胞体积=(a×10-10cm)3,密度ρ=4×$\frac{39×2+16}{{N}_{A}}$g÷(a×10-10cm)3=$\frac{94×4}{{N}_{A}×(a×1{0}^{-10})^{3}}$g•cm-3,
故答案为:K2O; $\frac{94×4}{{N}_{A}×(a×1{0}^{-10})^{3}}$.
点评 本题考查物质结构和性质,涉及晶胞计算、晶格能、原电池原理、等电子体、核外电子排布、分子结构与性质等知识点,同时考查学生分析问题、解决问题能力,需要学生具备扎实的基础,是对基础知识的综合考查.

 轻松暑假总复习系列答案
轻松暑假总复习系列答案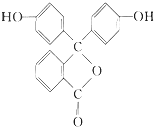
| A. | 酚酞具有弱酸性,且属于芳香烃 | |
| B. | 酚酞的分子式为C19H12O4 | |
| C. | 1mol酚酞最多与2molNaOH发生反应 | |
| D. | 酚酞在碱性条件下能够发生水解反应,呈现红色 |
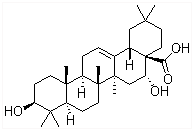 刺囊酸具有滋肝补血、凉血止血功能,结构式如图所示.下列关于刺囊酸的说法不正确的是( )
刺囊酸具有滋肝补血、凉血止血功能,结构式如图所示.下列关于刺囊酸的说法不正确的是( )| A. | 和氧所催化氧化后产物中含有醛基 | B. | 能和NaHCO3溶液反应生成CO2 | ||
| C. | 能使酸性高锰酸钾溶液褪色 | D. | 能发生取代、氧化、加成等反应 |
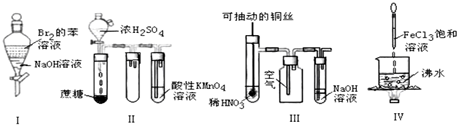
| A. | 实验Ⅰ:振荡后静置,上层溶液颜色保持不变 | |
| B. | 实验Ⅱ:酸性KMnO4溶液中出现气泡,且颜色逐渐褪去 | |
| C. | 实验Ⅲ:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色 | |
| D. | 实验Ⅳ:向沸水中滴加FeCl3溶液,继续煮沸溶液至红褐色,就可以制备FeCl3胶体 |
| A. | 碳原子数≤10 的烷烃,其一氯代物没有同分异构体的烷烃共有3种 | |
| B. | 烯烃、炔烃、芳香烃都能与溴水反应而使其褪色 | |
| C. | 等质量的CH≡CH和C6H6完全燃烧时消耗等物质的量的氧气 | |
| D. | 分子式为C6H12与C3H6的两种烃一定互为同系物 |
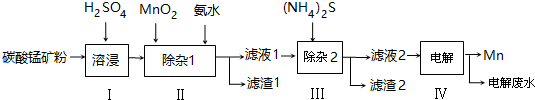
已知25℃,部分物质的溶度积常数如下:
| 物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
| Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
(2)步骤Ⅱ中,须加氨水调节溶液的pH为5.0~6.0,则滤渣1的主要成分为Fe(OH)3(填化学式).已知MnO2的作用为氧化剂,则得到该成分所涉及的离子方程式为2Fe2++MnO2+4H+=2Fe3++Mn2++2H2OFe3++3NH3﹒H2O=Fe(OH)3↓+3NH4+.
(3)步骤Ⅲ中,所加(NH4)2S的浓度不宜过大的原因是若(NH4)2S的浓度过大,产生MnS沉淀,造成产品损失.
(4)滤液2中,c(Co2+):c(Ni2+)=5:1.
(5)将质量为a㎏的碳酸锰矿经上述流程处理后得到单质Mn b kg.若每一步都进行完全,滤渣1为纯净物,质量为c kg,则原碳酸锰矿中MnCO3的质量分数为$\frac{(b-\frac{c}{107}×\frac{1}{2}×55)×\frac{115}{55}}{a}$×100%.(用含a、b、c的式子表达,无需化简)
| A. | 同一主族的元素,原子半径越大,其单质的熔点一定越高 | |
| B. | 只要含有金属阴离子的晶体就一定是离子晶体 | |
| C. | 第三周期元素的离子半径从左到右逐渐减小 | |
| D. | 同周期非金属氧化物对应的水化物的酸性从左到右依次增强 |
 近年来,我国北方地区雾霾频发.引起雾霾的PM2.5微细粒子包含(NH4)2 SO4、NH4NO3、有机微粒物及扬尘等,通过测定雾霾中锌等重金属的含量,可知交通污染是目前造成雾霾天气的主要原因之一,回答下列问题:
近年来,我国北方地区雾霾频发.引起雾霾的PM2.5微细粒子包含(NH4)2 SO4、NH4NO3、有机微粒物及扬尘等,通过测定雾霾中锌等重金属的含量,可知交通污染是目前造成雾霾天气的主要原因之一,回答下列问题: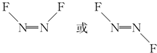 ,1molN2F2分子中所含σ键的数目是3NA.
,1molN2F2分子中所含σ键的数目是3NA.
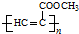 .
. .
.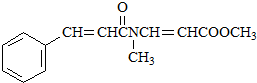 .
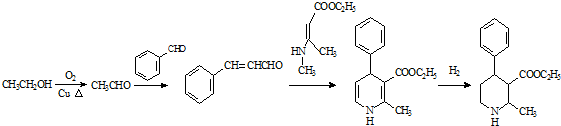
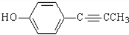
.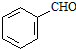 、CH3CH2OH和
、CH3CH2OH和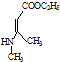 为原料,合成
为原料,合成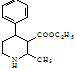 ,写出合成流程图(无机试剂任用).
,写出合成流程图(无机试剂任用).