题目内容
实验室制取少量N2常利用的反应是NaNO2+NH4Cl
NaCl+N2↑+2H2O,关于该反应的说法正确的是( )
| ||
| A、NaNO2是氧化剂 |
| B、生成1molN2时转移的电子为6mol |
| C、NH4Cl中的N元素被还原 |
| D、N2既是氧化剂又是还原剂 |
考点:氧化还原反应
专题:
分析:NaNO2+NH4Cl
NaCl+N2↑+2H2O中,N元素的化合价由+3价降低为0,N元素的化合价由-3价升高为0,以此来解答.
| ||
解答:
解:A.NaNO2中N元素的化合价降低,为氧化剂,故A正确;
B.只有N元素的化合价变化,则生成1molN2时转移的电子为3mol,故B错误;
C.NH4Cl中的N元素化合价升高,失去电子被氧化,故C错误;
D.N2既是氧化产物又是还原产物,故D错误;
故选A.
B.只有N元素的化合价变化,则生成1molN2时转移的电子为3mol,故B错误;
C.NH4Cl中的N元素化合价升高,失去电子被氧化,故C错误;
D.N2既是氧化产物又是还原产物,故D错误;
故选A.
点评:本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化及氧化还原反应基本概念为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
除去乙烷中混有的少量乙烯,应采用的简便方法是( )
| A、将混合气体通过氢氧化钠溶液 |
| B、将混合气体通过溴水 |
| C、将混合气体在催化剂条件下跟氢气反应 |
| D、使混合气体中的乙烯气体发生加聚反应 |
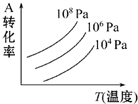 有一化学平衡mA(g)+nB(g)?pC(g)+qD(g),如图表示的是转化率与压强、温度的关系.下列叙述正确的是( )
有一化学平衡mA(g)+nB(g)?pC(g)+qD(g),如图表示的是转化率与压强、温度的关系.下列叙述正确的是( )| A、正反应是放热反应;m+n<p+q |
| B、正反应是吸热反应;m+n<p+q |
| C、正反应是放热反应;m+n>p+q |
| D、正反应是吸热反应;m+n>p+q |
已知:H2(g)+
O2(g)═H2O(g);△H=-Q1 kJ?mol-12H2(g)+O2(g)═2H2O(l);△H=-Q2 kJ?mol-1则下列判断正确的是( )
| 1 |
| 2 |
| A、2Q1>O2 | ||
| B、Q1>2Q2 | ||
| C、2Q1<Q2 | ||
D、
|
将铁片和锌片放在盛有NaCl溶液(其中滴有酚酞)的表面皿中,如图所示,最先观察到变为红色的区域为( )


| A、Ⅰ和Ⅱ | B、Ⅰ和Ⅳ |
| C、Ⅱ和Ⅲ | D、Ⅱ和Ⅳ |
向碘水中加入酒精,观察到的现象是( )
A、 |
B、 |
C、 |
D、 |
下列关于0.2mol/LBa(NO3)2溶液正确的说法是( )
| A、2L溶液中含有Ba+离子0.2mol |
| B、2L溶液中含有NO3-离子0.2mol |
| C、0.5L溶液中Ba2+离子的物质的量浓度为0.2mol/L |
| D、0.5L溶液中NO3-离子的物质的量浓度为0.2mol/L |
下列反应能用离子方程式CO32-+2H+=CO2↑+H2O表示的是( )
| A、NaHCO3+HCl=NaCl+CO2↑+H2O |
| B、BaCO3+2HCl=BaCl2+H2O+CO2↑ |
| C、Na2CO3+H2SO4=Na2SO4+CO2↑+H2O |
| D、K2CO3+2CH3COOH=2CH3COOK+CO2↑+H2O |
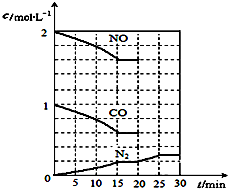 随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.