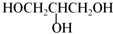题目内容
6.下列有关化学用语表示正确的有( )①Cl-的结构示意图:
 ②CCl4的结构式:
②CCl4的结构式:
③CO2的比例模型:
 ④Na2S的电子式:
④Na2S的电子式:
⑤二氧化碳的结构式:O=C=O ⑥HF的电子式:
 ⑦I-131:7853I
⑦I-131:7853I⑧CH4分子的比例模型:
 ⑨乙烯的结构简式:CH2CH2.
⑨乙烯的结构简式:CH2CH2.| A. | 2个 | B. | 3个 | C. | 4个 | D. | 5个 |
分析 ①Cl-的核外电子总数为18,最外层达到8电子稳定结构;
②CCl4的结构式中不需要标出未成键电子对;
③CO2的比例模型中,碳原子相对体积应该大于氧原子;
④Na2S为离子化合物,阴阳离子需要标出所带电荷;
⑤二氧化碳为直线型结构,分子中含有两个碳氧双键;
⑥HF为共价化合物,分子中不存在阴阳离子;
⑦元素符号的左上角为质量数、左下角为质子数;
⑧CH4分子为正四面体结构,碳原子半径大于氢原子;
⑨乙烯的结构简式中没有标出官能团碳碳双键.
解答 解:①Cl-的质子数为17,电子数为18,Cl-结构示意图为: ,故①错误;
,故①错误;
②四氯化碳为正四面体结构,CCl4的结构式为: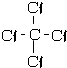 ,故②错误;
,故②错误;
③二氧化碳分子中,碳原子的相对体积大于氧原子,其正确的比例模型为: ,故③错误;
,故③错误;
④Na2S为离子化合物,钠离子用离子符号表示,硫离子标出最外层电子,硫化钠的电子式为 ,故④错误;
,故④错误;
⑤二氧化碳分子中含有两个碳氧双键,其结构式为:O=C=O,故⑤正确;
⑥氟化氢为共价化合物,F原子最外层达到8电子稳定结构,其电子式为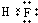 ,故⑥错误;
,故⑥错误;
⑦I-131的质量数为131,元素符号的左上角为质量数,该原子正确的表示方法为:13153I,故⑦错误;
⑧CH4分子为正四面体结构,碳原子相对体积大于氢原子,其比例模型为: ,故⑧正确;
,故⑧正确;
⑨乙烯分子中含有碳碳双键,其正确的结构简式为:CH2=CH2,故⑨错误;
根据分析可知,正确的为2个,
故选A.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及电子式、结构简式、比例模型、结构式、元素符号等知识,明确常见化学用语的书写原则为解答关键,试题培养了学生的规范答题能力.

练习册系列答案
相关题目
18.由A、B、C、D四种金属按表中装置图进行实验.
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是A-2e-═A2+.
(2)装置乙中正极的电极反应式是Cu2++2e-═Cu.
(3)装置丙中溶液的pH变大(填“变大”“变小”或“不变”).
(4)四种金属活泼性由强到弱的顺序是D>A>B>C.
(5)A、C形成合金,露置在潮湿空气中,A先被腐蚀.
| 装置 | 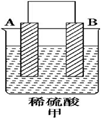 |  | 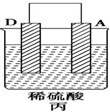 |
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
(1)装置甲中负极的电极反应式是A-2e-═A2+.
(2)装置乙中正极的电极反应式是Cu2++2e-═Cu.
(3)装置丙中溶液的pH变大(填“变大”“变小”或“不变”).
(4)四种金属活泼性由强到弱的顺序是D>A>B>C.
(5)A、C形成合金,露置在潮湿空气中,A先被腐蚀.
17.下列物质属于电解质的是( )
| A. | 氯化钠溶液 | B. | 氨水 | C. | 硝酸钾 | D. | 铝制导线 |
14.两份质量相同的CH4和NH3比较,下列结论错误的是( )
| A. | 分子个数比为17:16 | |
| B. | 同温同压下两种气体的体积之比是17:16 | |
| C. | 氢原子个数比为17:12 | |
| D. | 原子个数比为17:16 |
1.用下列装置进行的实验中,不能达到相应实验目的是( )
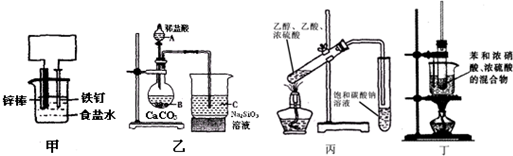

| A. | 装置甲:防止铁钉生锈 | B. | 装置乙:验证C的非金属性强于Si | ||
| C. | 装置丙:实验室制取乙酸乙酯 | D. | 装置丁:实验室制备硝基苯 |
15.已知 ,下列说法错误的是( )
,下列说法错误的是( )
 ,下列说法错误的是( )
,下列说法错误的是( )| A. | M的分子式为C6H10 | |
| B. | N能发生氧化反应和取代反应 | |
| C. | N的含有相同官能团的同分异构体有8种(不考虑立体结构) | |
| D. | M中所有碳原子在同一平面上 |
16.下列所述变化规律正确的是( )
| A. | Na、Mg、Al还原性依次增强 | |
| B. | S2-、Cl-、K+、Ca2+的离子半径依次减小 | |
| C. | HCl、PH3、H2S稳定性依次减弱 | |
| D. | Al(OH)3、Mg(OH)2、NaOH碱性依次减弱 |
 .
.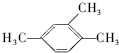 1,3,4-三甲苯
1,3,4-三甲苯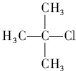 2-甲基-2-氯丙烷
2-甲基-2-氯丙烷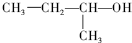 2-甲基-1-丙醇
2-甲基-1-丙醇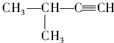 3-甲基-1-丁炔
3-甲基-1-丁炔