题目内容
1.用NA表示阿伏加德罗常数的值,下列说法正确的是( )| A. | 在20℃,1.01×105Pa时,22.4L甲烷(CH4)所含的原子数为5NA | |
| B. | 常温常压下,28g氮气所含的原子数为2NA | |
| C. | 标准状况下,22.4L水所含有的分子数目为NA | |
| D. | 0.5mol H2O所含的电子数目为9 NA |
分析 A.20℃不是标准状况,22.4L甲烷的物质的量不是1mol,据此解答即可;
B.28g氮气的物质的量为1mol,据此解答即可;
C.标准状况下,22.4L水的物质的量不是1mol,据此解答即可;
D.水分子中电子数=质子数,据此解答即可.
解答 解:A.20℃不是标准状况,22.4L甲烷的物质的量不是1mol,小于1mol,故22.4L甲烷(CH4)所含的原子数小于5NA,故A错误;
B.28g氮气的物质的量=$\frac{28g}{28g/mol}$=1mol,氮气是双原子分子,故含有原子数为2NA,故B正确;
C.标准状况下,水为液体,不能利用气体摩尔体积计算其物质的量,故C错误;
D.0.5mol水中含有电子的物质的量为0.5mol×(1×2+8)=5mol,故D错误,
故选B.
点评 本题考查了学生对物质的量、粒子数、质量、体积等与阿伏加德罗常数关系的理解,又可以涵盖多角度的化学知识内容.要准确解答好这类题目,一是要掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系;二是要准确弄清分子、原子、原子核内质子中子及核外电子的构成关系.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9.NA为阿伏加德罗常数,下列有关说法中不正确的是( )
| A. | 标准状况下,22.4L氦气含有NA个氦原子 | |
| B. | 20g重水含有10 NA个电子 | |
| C. | 12.5mL l6mol•L-1浓硫酸与足量铜反应,转移电子数为0.2NA | |
| D. | 1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA |
13.将2.4g Fe、Mg合金投入到一定量的稀硝酸中,金属与硝酸恰好完全反应,共收集到标准状况下的气体VL(硝酸被还原成NO),若向反应后的溶液中加入足量的NaOH溶液,待金属元素全部沉淀后,再将沉淀过滤、洗涤、灼烧后称量,质量为3.6g.则收集到的气体体积V的值不可能为( )
| A. | 1.016 | B. | 1.00 | C. | 0.986 | D. | 2.24 |
10.下列关于CaCO3的叙述错误的是( )
| A. | CaCO3俗名石灰石,属于碳酸盐 | |
| B. | CaCO3属于含氧酸盐 | |
| C. | 实验室用煅烧CaCO3来制备二氧化碳 | |
| D. | CaCO3 属于难溶性的钙盐 |
11.下列实验方法或操作能达到实验目的是( )
| A. | 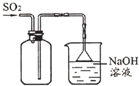 收集SO2 收集SO2 | |
| B. | 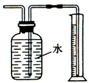 测量Cu与浓硝酸反应生成二氧化氮体积 测量Cu与浓硝酸反应生成二氧化氮体积 | |
| C. | 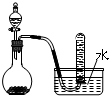 二氧化锰固体和双氧水制取O2 二氧化锰固体和双氧水制取O2 | |
| D. | 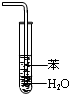 吸收HCl 吸收HCl |
 如图表示800℃时A、B、C三种气体物质的浓度随时间的变化情况,t1是达到平衡状态的时间.试回答:
如图表示800℃时A、B、C三种气体物质的浓度随时间的变化情况,t1是达到平衡状态的时间.试回答: 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知1mol H2(g)、CO(g)和CH3OH(l)的燃烧放出的热量为分别为285.8kJ、283.0kJ和726.5kJ.请回答下列问题:
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知1mol H2(g)、CO(g)和CH3OH(l)的燃烧放出的热量为分别为285.8kJ、283.0kJ和726.5kJ.请回答下列问题: