题目内容
盖斯定律在生产和科学研究中有很重要的作用,有些反应的反应热虽然无法直接测得,但可以利用盖斯定律间接计算求得.已知7.2g碳在12.8g的氧气中燃烧,至反应物耗尽,放出x kJ热量.已知单质碳的燃烧热为y kJ?mol-1,则1mol C与O2反应生成CO的反应热△H为( )
| A、-(2.5x-0.5 y) kJ?mol-1 |
| B、-(5x-0.5y) kJ?mol-1 |
| C、-(10x-y)kJ?mol-1 |
| D、-y kJ?mol-1 |
考点:有关反应热的计算
专题:
分析:碳在氧气中燃烧,氧气不足发生反应2C+O2
2CO,氧气足量发生反应C+O2
CO2.7.2g碳的物质的量为0.6mol,12.8g的氧气的物质的量为0.4mol,n(C):n(O2)=3:2,介于2:1与1:1之间,所以上述反应都发生.令生成的CO为xmol,CO2为ymol,根据碳元素与氧元素守恒列方程计算x、y的值,计算生成ymol二氧化碳方程的热量,放出的总热量减去生成二氧化碳放出的热量为生成xmolCO放出的热量,据此计算1molC与O2反应生成CO的反应热△H.
| ||
| ||
解答:
解:碳在氧气中燃烧,氧气不足发生反应2C+O2
2CO,氧气足量发生反应C+O2
CO2.
7.2g碳的物质的量为0.6mol,12.8g的氧气的物质的量为0.4mol,n(C):n(O2)=3:2,介于2:1与1:1之间,所以上述反应都发生.
令生成的CO为xmol,CO2为ymol,
根据碳元素守恒有x+y=0.6,根据氧元素守恒有x+2y=0.4×2,联立方程,解得x=0.4,y=0.2.
单质碳的燃烧热为Y kJ/mol,所以生成0.1mol二氧化碳放出的热量为0.2mol×Y kJ/mol=0.2YkJ,
所以生成0.4molCO放出的热量为XkJ-0.2YkJ.
由于碳燃烧为放热反应,所以反应热△H的符号为“-”,
故1mol C与O2反应生成CO的反应热△H=-
kJ?mol-1
=-(2.5x-0.5 y) kJ?mol-1.
故选A.
| ||
| ||
7.2g碳的物质的量为0.6mol,12.8g的氧气的物质的量为0.4mol,n(C):n(O2)=3:2,介于2:1与1:1之间,所以上述反应都发生.
令生成的CO为xmol,CO2为ymol,
根据碳元素守恒有x+y=0.6,根据氧元素守恒有x+2y=0.4×2,联立方程,解得x=0.4,y=0.2.
单质碳的燃烧热为Y kJ/mol,所以生成0.1mol二氧化碳放出的热量为0.2mol×Y kJ/mol=0.2YkJ,
所以生成0.4molCO放出的热量为XkJ-0.2YkJ.
由于碳燃烧为放热反应,所以反应热△H的符号为“-”,
故1mol C与O2反应生成CO的反应热△H=-
| X-0.2Y |
| 0.4 |
=-(2.5x-0.5 y) kJ?mol-1.
故选A.
点评:本题考查反应热的计算,难度不大,判断碳与氧气反应产物中一氧化碳与二氧化碳的物质的量是关键,注意反应热△H的单位与符号,容易忽略.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
有一种兴奋剂的结构简式如图,下列有关该物质的说法正确的是( )
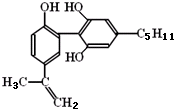

| A、该分子中所有碳原子可以稳定的共存在一个平面中 |
| B、1mol该物质与浓溴水和H2反应时,最多消耗Br2和H2的物质的量分别为4mol、7mol |
| C、遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物 |
| D、滴入酸性KMnO4溶液,观察到紫色褪去,可证明分子中存在双键 |
下列说法中正确的一组是( )
| A、H2和D2互为同位素; |
B、 和 和  是同一种物质 是同一种物质 |
C、碳链为  与 与  是同分异构体 是同分异构体 |
| D、金刚石、石墨和“足球烯”C60为同系物 |
下列物质不能作为食品添加剂的是( )
| A、甲醇 | B、食盐 |
| C、味精 | D、苯甲酸钠 |
向某密闭容器中加入0.3molA,0.1molC和一定量的B三种气体在一定条件下发生反应,各物质浓度随时间变化如甲图所示[t0~tl阶段的c(B)变化未画出].乙图为t2时刻后改变条件平衡体系中正、逆反应速率随时间变化的情况,且四个阶段都各改变一种反应条件(浓度、温度、压强、催化剂)且互不相同,t3~t4阶段为使用催化剂.下列说法中正确的是( )
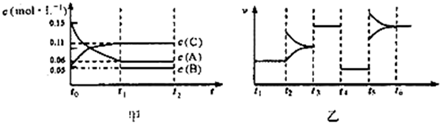

| A、其他条件不变时,增大压强,B的转化率不变 |
| B、t4~t5阶段改变的条件为降低温度 |
| C、B的起始物质的量为0.02mol |
| D、若t5~t6阶段改变的条件为升高温度,则正反应为吸热反应 |
化学与人类生活密切相关.下列说法正确的是( )
| A、苯酚有一定毒性,不能作消毒剂和防腐剂 |
| B、棉花、羊毛、木材主要成分都是纤维素 |
| C、油脂皂化生成的高级脂肪酸钠是肥皂的有效成分 |
| D、葡萄糖分子式为:CH2OH(CHOH)4CHO |
随着卤素(F、Cl、Br、I)原子半径的增大,下列递变规律正确的是( )
| A、单质熔、沸点逐渐降低 |
| B、气态氢化物稳定性逐渐增强 |
| C、卤素离子的还原性逐渐增强 |
| D、单质的氧化性逐渐增强 |
下列变化中,必须加入氧化剂才能发生的是( )
| A、SO2→S |
| B、Na2O2→O2 |
| C、Fe2+→Fe3+ |
| D、HCO3-→CO32- |