题目内容
16.在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是( )| A. | 甲的相对分子质量比乙的相对分子质量小 | |
| B. | 甲的Vm比乙的Vm小 | |
| C. | 甲的分子数比乙的分子数少 | |
| D. | 甲中所含的原子数比乙中的所含的原子数少 |
分析 同温同压下,体积之比等于物质的量之比,由等质量的甲、乙两种气体,且甲的密度大于乙的密度,则甲中的气体的体积小,以此来解答.
解答 解:同温同压下,体积之比等于物质的量之比,由等质量的甲、乙两种气体,且甲的密度大于乙的密度,则甲中的气体的体积小,
A.相同质量时,甲的物质的量小,则甲的摩尔质量大,故A错误;
B.相同状况下,气体的摩尔体积相同,故B错误;
C.甲的体积小,物质的量小,则甲的分子数小,故C正确;
D.体积与物质的量成正比,则甲的物质的量少,不知分子的组成,故D错误;
故选C.
点评 本题考查阿伏伽德罗定律及推论,注意体积、物质的量的关系及习题中的信息应用即可解答,选项A为解答的易错点,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.下列叙述不正确的是( )
| A. | 1 mol H2约含有6.02×1023个氢分子 | |
| B. | 1 mol H2O的质量为18 g | |
| C. | 1 mol O2的体积为22.4 L | |
| D. | 1L 1 mol/L NaCl溶液中含1 molNa+ |
7.已知反应10AgF+5Cl2+5H2O=9AgCl+AgClO3+10HF+O2,则有1molO2生成时反应所转移的电子总数为(NA表示阿伏加德罗常数的值)( )
| A. | 9 NA | B. | 4 NA | C. | 10 NA | D. | 5 NA |
4.基态原子的核外电子排布为[Kr]4d105s1的元素属于的区、周期和族为( )
| A. | p区、第五周期、ⅠB族 | B. | ds区、第五周期、ⅠB族 | ||
| C. | d区、第四周期、ⅠB族 | D. | ds区、第五周期、Ⅷ族 |
1.已知FeCl3溶液中存在下列平街:Fe3++3H2O?Fe(OH)3+3H+,下列操作能使FeCl3的水解程度增大且溶液的酸性增强的是( )
| A. | 加入FeCl3固体 | B. | 加水 | C. | 加入少量浓盐酸 | D. | 升温 |
8.关于SO2气体的叙述中,正确的是( )
| A. | SO2的摩尔质量是64 g | |
| B. | 1mol SO2中所含分子数约为6.02×1023 | |
| C. | 1 mol SO2的质量是64 g•mol-1 | |
| D. | 25℃,1.01×105Pa下,1 mol SO2的体积为22.4 L |
5.下列化学用语表达不正确的是( )
| A. | 氨分子的电子式: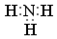 | B. | CO2分子的结构式:O=C=O | ||
| C. | S2-的离子结构示意图: | D. | 苯分子的结构简式: |
17.设NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A. | 常温下,500mL 2mol•L-1的Na2CO3溶液中含Na+数目为NA | |
| B. | 常温下,2.7g铝与足量盐酸反应,失去电子数为0.3NA | |
| C. | 1.8gNH4+的离子中含有的质子数为0.1NA | |
| D. | 标准状况下,1 L水所含分子数为$\frac{1}{22.4}$NA |