题目内容
6.某原电池的电池反应为Fe+2Fe3+=3Fe2+,以下给出原电池中正极、负极、电解质溶液可能的材料,其中与此电池反应不符的原电池给合是( )| A. | 铜片、铁片、FeCl3溶液组成的原电池 | |
| B. | 石墨、铁片、FeCl3溶液组成的原电池 | |
| C. | 镁片、锌片、Fe2(SO4)3溶液组成的原电池 | |
| D. | 银片、铁片、Fe(NO3)3溶液组成的原电池 |
分析 根据电池反应式知,Fe失电子化合价升高作负极,不如Fe活泼的金属或导电的非金属作正极,可溶性铁盐溶液为电解质溶液,据此分析解答.
解答 解:根据电池反应式知,Fe失电子化合价升高作负极,不如Fe活泼的金属或导电的非金属作正极,可溶性铁盐溶液为电解质溶液,
A.Cu的活泼性小于Fe,氯化铁为可溶性铁盐,符合该反应,故A不选;
B.C的活泼性小于Fe,氯化铁为可溶性铁盐,符合该反应,故B不选;
C.电极材料无铁,不符合该反应,故C选;
D.Ag的活泼性小于Fe,硝酸铁为可溶性铁盐,符合该反应,故D不选;
故选C.
点评 本题考查了原电池原理,在电极材料发生反应的原电池中,失电子化合价升高的金属作负极,得电子发生还原反应可溶性电解质为电解质溶液,题目难度不大.

练习册系列答案
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案
相关题目
17.下列叙述正确的是( )
| A. | 水的相对分子质量为18g/mol | |
| B. | 一个水分子的质量为18g | |
| C. | 1mol水的质量是18g | |
| D. | 1mol水中含有2个氢原子和1个氧原子 |
14.现有两种有机化合物,不论以何种比例混合,只要物质的量之和不变,则完全燃烧时消耗氧气和生成的水的物质的量也不变.则它们可能是( )
| A. | 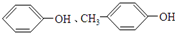 | B. | 甲苯和C3H8O3 | ||
| C. | CH4、C2H4O2 | D. | C3H4、C3H6O |
1. 工业上采用NH3作还原剂脱氮原理为:NO(g)+NO2(g)+2NH3(g)?2N2(g)+3HO(g),烟气以一定的流速通过,测量不同温度下逸出气体中氮氧化物含量,从而确定烟气效率,右图是两种不同催化剂的脱氮效率曲线,判断以下分析不正确的是( )
工业上采用NH3作还原剂脱氮原理为:NO(g)+NO2(g)+2NH3(g)?2N2(g)+3HO(g),烟气以一定的流速通过,测量不同温度下逸出气体中氮氧化物含量,从而确定烟气效率,右图是两种不同催化剂的脱氮效率曲线,判断以下分析不正确的是( )
 工业上采用NH3作还原剂脱氮原理为:NO(g)+NO2(g)+2NH3(g)?2N2(g)+3HO(g),烟气以一定的流速通过,测量不同温度下逸出气体中氮氧化物含量,从而确定烟气效率,右图是两种不同催化剂的脱氮效率曲线,判断以下分析不正确的是( )
工业上采用NH3作还原剂脱氮原理为:NO(g)+NO2(g)+2NH3(g)?2N2(g)+3HO(g),烟气以一定的流速通过,测量不同温度下逸出气体中氮氧化物含量,从而确定烟气效率,右图是两种不同催化剂的脱氮效率曲线,判断以下分析不正确的是( )| A. | 上述反应的正反应为放热反应 | |
| B. | 催化剂①、②分别适合于250℃和450℃左右脱氮 | |
| C. | 曲线①、②最高点表示此时平衡转化率最高 | |
| D. | 相同条件下,改变压强对脱氮率没有影响 |
11.下列有关粒子的表示方法正确的是( )
| A. | CO2的结构式:O=C=O | B. | CH4的球棍模型: | ||
| C. | H2O的电子式: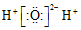 | D. | C2H4的结构简式:CH2=CH2 |
18.在aXn-和bYm+两种简单离子,且X、Y均为短周期元素,已知Xn-比Ym+多2个电子层,下列关系和说法正确的是( )
| A. | X只能是第三周期元素 | B. | a-b+n+m的和只可能等于10 | ||
| C. | b一定等于1 | D. | Y可能是第二周期元素 |
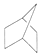 C.CH2=CH-CH=CH2 D.HOOCCH2CH2CH2Cl
C.CH2=CH-CH=CH2 D.HOOCCH2CH2CH2Cl
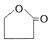 则E的结构简式NaOOCCH2CH2CH2OH,F生成五元环酯的化学方程式HOOCCH2CH2CH2OH$→_{△}^{浓硫酸}$
则E的结构简式NaOOCCH2CH2CH2OH,F生成五元环酯的化学方程式HOOCCH2CH2CH2OH$→_{△}^{浓硫酸}$ 乙醇是一种重要的有机化工原料,它可以用玉米、薯类等为原料发酵、蒸馏制成.乙醇和汽油经加工处理形成的车用燃料即乙醇汽油.
乙醇是一种重要的有机化工原料,它可以用玉米、薯类等为原料发酵、蒸馏制成.乙醇和汽油经加工处理形成的车用燃料即乙醇汽油.