题目内容
11.下列各组物质发生反应时,生成物随着反应条件或反应物用量变化而发生变化的是( )| A. | N2和O2 | B. | Na和O2 | C. | S和O2 | D. | Al和O2 |
分析 A.氮气与氧气反应生成一氧化氮,产物与反应条件、反应物的用量无关;
B.Na和O2反应的条件的不同,生成物也不同;
C.硫与氧气反应生成二氧化流,产物与反应条件、反应物的用量无关;
D.铝与氧气反应生成氧化铝,产物与反应条件、反应物的用量无关.
解答 解:A.N2+O2$\frac{\underline{\;放电\;}}{\;}$2NO,产物与反应条件、反应物的用量无关,故A不选;
B.Na和O2在常温下反应生成氧化钠,Na和O2在加热条件下反应生成氧化钠,反应条件改变,会引起产物的种类改变,故B选;
C.S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2,产物与反应条件、反应物的用量无关,故C不选;
D.4Al+3O2=2Al2O3,无论在常温下还是在加热条件下都生成氧化铝,产物与反应条件、反应物的用量无关,故D不选;
故选B.
点评 本题是对物质之间反应物量的不同导致的结果不同的考查,解题的关键是掌握具体的反应产物的不同,属于物质之间反应的探讨,题目难度不大.

练习册系列答案
相关题目
2.下列有关化学用语表示正确的是( )
| A. | 质子数为35、中子数为45的溴原子:3545Br | |
| B. | Al3+的结构示意图: | |
| C. | 羟基的电子式: | |
| D. | 乙醇的结构简式:C2H6O |
19.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 28 g铁粉与酸反应失去的电子数是NA | |
| B. | 标准状况下,11.2 L NH3含有的原子总数为1.5NA | |
| C. | 0.5 mol•L-1 K2SO4溶液中所含K+的数目为NA | |
| D. | 46 g N02和N2O4的混合气体含有的原子总数为3NA |
6. 合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如表:
合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如表:
(1)①由上表数据可知该反应为放热 (填放热,吸热,无法确定 )反应.
②下列措施能用勒夏特列原理解释是ad.(填序号)
a.增大压强有利于合成氨 b.使用合适的催化剂有利于快速生成氨
c.生产中需要升高温度至500°C左右 d.需要使用过量的N2,提高H2转化率
(2)0.2mol氨气溶于水后再与含有0.2mol硫酸的溶液反应放热QkJ,请你用热化学方程式表示其反应
式NH3.H2O(aq)+H2SO4(aq)=NH4HSO4(aq)+H2O(l)△H=-5Q kJ•mol-1.
(3)常温时,将amol氨气溶于水后,再通入bmol氯化氢,溶液体积为1L,且c(NH4+)=c(Cl-),则一水合
氨的电离平衡常数Kb=$\frac{1{0}^{-7}b}{a-b}$.(用ab表示)
(4)原料气H2可通过反应 CH4(g)+H2O (g)?CO(g)+3H2(g) 获取,已知该反应中,当初始混合气
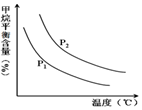
中的$\frac{n({H}_{2}O)}{n(C{H}_{4})}$恒定时,温度、压强对平衡混合气CH4含量的影响如图所示:
①图中,两条曲线表示压强的关系是:P1<P2
(填“>”、“=”或“<”).
②其它条件一定,升高温度,氢气的产率会增大.(填“增大”,“减小”减小,“不变”不变)
(5)原料气H2还可通过反应CO(g)+H2O(g)?CO2 (g)+H2(g) 获取.
①T℃时,向容积固定为5L的容器中充入1mol水蒸气和1mol CO,反应达平衡后,测得CO的浓度为0.08mol•L-1,该温度下反应的平衡常数K值为2.25.
②保持温度仍为T℃,容积体积为5L,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是cd(填序号).
a.容器内压强不随时间改变 b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n(CO):n(H2O):n(CO2):n(H2)=1:16:6:6.
 合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如表:
合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如表:| 温 度(℃) | 360 | 440 | 520 |
| K值 | 0.036 | 0.010 | 0.0038 |
②下列措施能用勒夏特列原理解释是ad.(填序号)
a.增大压强有利于合成氨 b.使用合适的催化剂有利于快速生成氨
c.生产中需要升高温度至500°C左右 d.需要使用过量的N2,提高H2转化率
(2)0.2mol氨气溶于水后再与含有0.2mol硫酸的溶液反应放热QkJ,请你用热化学方程式表示其反应
式NH3.H2O(aq)+H2SO4(aq)=NH4HSO4(aq)+H2O(l)△H=-5Q kJ•mol-1.
(3)常温时,将amol氨气溶于水后,再通入bmol氯化氢,溶液体积为1L,且c(NH4+)=c(Cl-),则一水合
氨的电离平衡常数Kb=$\frac{1{0}^{-7}b}{a-b}$.(用ab表示)
(4)原料气H2可通过反应 CH4(g)+H2O (g)?CO(g)+3H2(g) 获取,已知该反应中,当初始混合气
中的$\frac{n({H}_{2}O)}{n(C{H}_{4})}$恒定时,温度、压强对平衡混合气CH4含量的影响如图所示:
①图中,两条曲线表示压强的关系是:P1<P2
(填“>”、“=”或“<”).
②其它条件一定,升高温度,氢气的产率会增大.(填“增大”,“减小”减小,“不变”不变)
(5)原料气H2还可通过反应CO(g)+H2O(g)?CO2 (g)+H2(g) 获取.
①T℃时,向容积固定为5L的容器中充入1mol水蒸气和1mol CO,反应达平衡后,测得CO的浓度为0.08mol•L-1,该温度下反应的平衡常数K值为2.25.
②保持温度仍为T℃,容积体积为5L,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是cd(填序号).
a.容器内压强不随时间改变 b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n(CO):n(H2O):n(CO2):n(H2)=1:16:6:6.
16.下列有关化学用语的描述不正确的是( )
| A. | MgF2的电子式: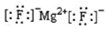 | |
| B. | 中子数为15的硅原子:${\;}_{14}^{29}$Si | |
| C. | 乙烯的结构简式:CH2CH2 | |
| D. | NH3•H2O 的电离方程式:NH3•H2O?NH4++OH- |
3.下列离子方程式书写正确是( )
| A. | 氯化亚铁溶液中加入稀硝酸:3Fe2++4H++NO 3-═3Fe 3++2H2O+NO↑ | |
| B. | 氧化亚铁溶于稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+3H2O | |
| C. | 固体氯化钠与浓硫酸混合加热:H 2SO 4+2Cl-═SO 2↑+Cl 2↑+H 2O | |
| D. | 稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑ |
1.氧、硅、铝是地壳中含量最多的三种元素,下列叙述正确的是( )
| A. | 普通玻璃、水泥成分中都含有这三种元素 | |
| B. | 自然界中存在单质硅 | |
| C. | 氧元素与另外两种元素形成的二元化合物都能与NaOH的浓溶液反应 | |
| D. | 电解熔融状态的SiO2和A12O3可以制得Si、A1,且都有氧气生成 |
