题目内容
设NA为阿伏加德罗常数的数值,下列说法正确的是
A.500 mL 2 mol·L-1 FeCl3溶液中Fe3+数为NA,且 =3
=3
B.1 L pH=1的硫酸溶液中含有的H+为0.2NA
C.标准状况下,22.4L 乙烷中含极性共价键的数目为7NA
D.12 g石墨和C60的混合物中质子总数一定为6NA个
D
【解析】
试题分析:A、氯化铁溶液中,铁离子发生水解,使 >3,错误;B、pH=1的溶液中氢离子的浓度是0.1mol/L,则1L溶液中氢离子的物质的量是0.1mol,数目是0.1NA,错误;C、标准状况下,22.4L乙烷的物质的量是1mol,1个乙烷分子中含有6个极性共价键,所以标准状况下,22.4L 乙烷中含极性共价键的数目为6NA,错误;D、石墨和C60都是C元素的单质,构成原子都是C原子,所以12 g石墨和C60的混合物中C原子的物质的量是1mol,1个C原子中含有个质子,所以质子总数一定为6NA个,正确,答案选D。
>3,错误;B、pH=1的溶液中氢离子的浓度是0.1mol/L,则1L溶液中氢离子的物质的量是0.1mol,数目是0.1NA,错误;C、标准状况下,22.4L乙烷的物质的量是1mol,1个乙烷分子中含有6个极性共价键,所以标准状况下,22.4L 乙烷中含极性共价键的数目为6NA,错误;D、石墨和C60都是C元素的单质,构成原子都是C原子,所以12 g石墨和C60的混合物中C原子的物质的量是1mol,1个C原子中含有个质子,所以质子总数一定为6NA个,正确,答案选D。
考点:考查阿伏伽德罗常数与微粒数、化学键数的关系

(10分) CO2和CH4是两种重要的温室气体,通过CH4和CO2反应来制造更高价值的化学品是目前的研究目标。
(1)250 ℃时,以镍合金为催化剂,向体积为4 L的密闭容器中通入6 mol CO2、6 mol CH4,发生如下反应:CO2(g)+CH4(g) 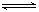 ?2CO(g)+2H2(g)。
?2CO(g)+2H2(g)。
平衡体系中各组分体积分数(某一成分物质的量占总气体物质的量的百分数)如下表:
物质 | CH4 | CO2 | CO | H2 |
体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
①此温度下该反应的平衡常数K=________。
②已知:CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
CO(g)+H2O(g)===CO2(g)+H2(g) ΔH=+2.8 kJ·mol-1
2CO(g)+O2(g)===2CO2(g) ΔH=-566.0 kJ·mol-1
反应CO2(g)+CH4(g) ===?2CO(g)+2H2(g) ΔH=________。
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如下图所示。250~300 ℃时,乙酸的生成速率减小的原因是__________________________________________________。

②将Cu2Al2O4溶解在稀硝酸中的离子方程式为_______________________________。
(3)以CO2为原料可以合成多种物质。
如合成聚碳酸酯。已知CO2的分子结构为O===C===O,它的“C===O”双键与乙烯的“C===C”双键一样,在一定条件下可发生加聚反应,聚碳酸酯是一种易降解的新型合成材料,它是由CO2加聚而成。写出聚碳酸酯的结构简式:______________________________________。
(12分)某研究性学习小组在网上收集到如下信息:钾、钙、钠、镁等活泼金属都能在CO2气体中燃烧。他们对钠在CO2气体中燃烧后的产物中的白色物质进行了如下探究:
[实验]将燃烧的钠迅速伸入装满CO2的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底附着黑色颗粒,瓶壁上粘附着白色物质。
[提出假设]
假设1:白色物质是Na2O。
假设2:白色物质是Na2CO3。
假设3:白色物质是Na2O和Na2CO3的混合物。
[设计实验方案验证假设]该小组对燃烧后的白色产物进行如下探究:
实验 方案 | 实验操作 | 实验 现象 | 结论 |
方案1 | 取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 | 溶液变 成红色 | 白色物质为Na2O |
方案2 | ①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2溶液 | 出现白 色沉淀 | |
②静置片刻,取上层清液于试管中,滴加无色酚酞试液 | 无明显现象 |
(1)甲同学认为方案1得到的结论不正确,其理由是____________________。
(2)乙同学认为方案2得到的结论正确,白色物质为____________________。
(3)通过方案1和方案2的实验,你认为上述三个假设中,________成立。
(4)钠在二氧化碳中燃烧的化学方程式为__________________________________________。
(5)丙同学认为白色物质有可能是氢氧化钠。你是否同意丙同学的观点,并简述理由:______________、
________________________________________________________。
 2C(g),达到平衡时生成0.6 mol C。下列说法正确的是
2C(g),达到平衡时生成0.6 mol C。下列说法正确的是
 。则下列判断错误的是
。则下列判断错误的是