题目内容
汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3 = K2O+5Na2O+16N2↑。若氧化产物比还原产物多1.75 mol,则下列判断错误的是
A.有0.250 mol KNO3被氧化
B.生成44.8 L N2(标准状况)
C.转移电子的物质的量为1.25 mol
D.被氧化的N原子的物质的量为3.75 mol
A
【解析】
试题分析:A.在反应10NaN3+2KNO3 = K2O+5Na2O+16N2↑中,NaN3中的N化合价升高,失去电子,作还原剂,KNO3中的N化合价降低,得到电子,作氧化剂。每产生16mol的N2,转移电子10mol, 氧化产物比还原产物多14mol。现在氧化产物比还原产物多1.75 mol,则KNO3被还原的物质的量是:(2mol÷ 14mol)×1.75 mol=0. 25 mol,错误;B.根据方程式可知:产生16mol的N2时,氧化产物比还原产物多14mol。现在氧化产物比还原产物多1.75 mol,则产生N2的物质的量是(16÷14)mol×1.75 mol =2mol,其体积在标准状况下体积是2mol×22.4L/mol=44.8 L,正确;C.每转移10mol的电子,氧化产物比还原产物多14mol。现在氧化产物比还原产物多1.75 mol,则转移电子的物质的量为(10÷14)×1.75 mol =1.25 mol,正确;D.根据方程式可知:被氧化30mol的N原子,氧化产物比还原产物多14mol。现在氧化产物比还原产物多1.75 mol,被氧化的N原子的物质的量为(30÷14)×1.75 mol =3.75 mol。
考点:考查氨气气囊中发生氧化还原反应中的电子转移、物质的作用的计算的知识。

(12分)I.在温度为T时,向2.0 L恒容密闭容器中充入1.0 mol A和1.0 mol B,发生反应A(g)+B(g)  C(g),一段时间后达到平衡。测定得部分数据见下表:
C(g),一段时间后达到平衡。测定得部分数据见下表:
t/s | 0 | 5 | 15 | 25 | 35 |
n(A)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
回答下列问题:
(1)反应前5 s的平均反应速率v(A) =____________
(2)温度为T时,该反应的化学平衡常数=
(3)升高温度,平衡时c(A)=0.41 mol·L-1,则反应的ΔH (填 “>0” 或 “<0”)
(4)相同温度下,起始时向容器中充入0.2 mol A、0.2 mol B和1.0 mol C,反应达到平衡前,反应速率v正 v逆(填“>” 或 “<”)
(5)下列措施能增大反应速率,且平衡往正反应方向移动是 。
a.及时分离出A气体
b.适当升高温度
c.增大B的浓度
d.选择高效催化剂
II.NO、NO2是常见的氧化物。用H2或CO催化还原NO可达到消除污染的目的。
已知:2NO(g) = N2(g) + O2(g) △H = -180.5kJ·mol-1
2H2O(l) = 2H2(g) + O2(g) △H = +571.6kJ·mol-1
则用H2催化还原NO消除污染的热化学方程式是

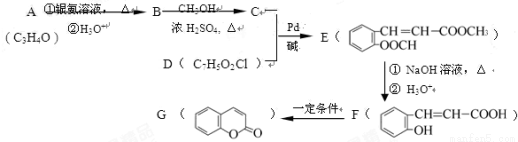
 )常用作香豆素的替代品,鉴别二氢香豆素和它的一种同分异构体(
)常用作香豆素的替代品,鉴别二氢香豆素和它的一种同分异构体( )需要用到的试剂有:NaOH溶液、 。
)需要用到的试剂有:NaOH溶液、 。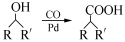 (R,R′为烃基),试写出以苯和丙烯(
(R,R′为烃基),试写出以苯和丙烯( =CH—CH3)为原料,合成
=CH—CH3)为原料,合成 的路线流程图(无机试剂任选)。合成路线流程图示例如下:
的路线流程图(无机试剂任选)。合成路线流程图示例如下:





 =3
=3

