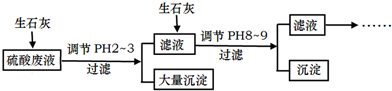
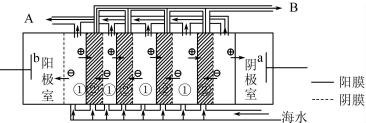
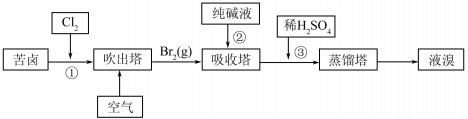
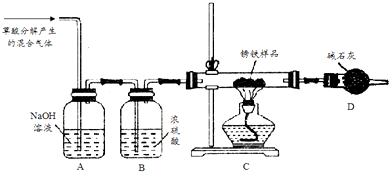
题目内容
10.在一定温度下的某容积可变的密闭容器中,建立下列化学平衡:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),能说明该可逆反应在一定条件下已达到化学平衡状态的是( )| A. | 体系的压强不再发生变化 | |
| B. | v(CO2)=v(H2O) | |
| C. | 生成n mol CH3OH的同时生成n mol H2O | |
| D. | 3 mol H-H键断裂的同时断裂2 mol H-O键 |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:A、一定温度下的某容积可变的密闭容器中,压强是一个定值,不能作平衡状态的标志,故A错误;
B、只要反应发生就符合v(CO2)=v(H2O),所以不能作平衡的标志,故B错误;
C、生成n mol CH3OH的同时生成n mol H2O,都体现的正反应方向,故C错误;
D、当体系达平衡状态时,3 mol H-H键断裂等效于2 mol H-O键形成的同时断裂2 mol H-O键,故D正确;
故选D.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.已知X、Y、Z三种元素的原子序数依次递增,X原子的电子层数与它的核外电子总数相等,而Z原子的最外层电子数是次外层的3倍,Y和Z可以形成两种以上气态化合物,则下列说法错误的是( )
| A. | Y和Z可以组成一种Y和Z的质量比为7:8的化合物 | |
| B. | X、Y、Z组成的盐中既含离子键又含共价键 | |
| C. | X和Z可以组成原子个数比分别为1:1和2:1,常温下为液态的两种化合物 | |
| D. | 由X、Y、Z三种元素中的任意两种组成的具有10电子的微粒仅有2种 |
1.化学与科学、技术、社会、环境密切相关,下列说法中正确的是( )
| A. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| B. | 明矾净水的原理和“84”消毒液消毒的原理相同 | |
| C. | 为了防止中秋月饼等富脂食品氧化变质,延长保质期,可在包装袋中放入生石灰 | |
| D. | 光化学烟雾与大量排放碳氢化合物和氮氧化合物有关 |
18.某无色溶液能溶解Al(OH)3,则此溶液中一定能大量共存的离子组是( )
| A. | Fe2+、Cl-、Na+、NO3- | B. | Na+、Ba2+、Cl-、NO3- | ||
| C. | K+、Na+、NO3-、HCO3- | D. | Na+、K+、AlO2-、SO42- |
2.下列有关反应速率说法正确的是( )
| A. | C(s)+H2O(g)?CO(g)+H2(g) 加入大量C固体,V正 增大,V逆 减小 | |
| B. | Zn(s)+HCl(aq)═ZnCl2(aq)+H2(g),使用纯锌比粗锌反应速率快 | |
| C. | 对于反应H2(g)+I2(g)?2HI(g),恒温恒容充入Ne,容器内压强增大,V正、V逆 均增大 | |
| D. | 对于反应2SO2(g)+O2(g)═2SO3(g)当升高温度V正、V逆 都加快 |
19.25℃时,溶质浓度均为0.1mol/L的下列溶液中粒子浓度关系正确的是已知:H2C2O4属于二元弱酸.( )
| A. | Na2S溶液:c(Na+)>c(S2-)>c(HS-)>c(OH-)>c(H2S) | |
| B. | Na2CO3溶液:c(Na+)+c(H+)=c(CO${\;}_{3}^{2-}$)+c(HCO${\;}_{3}^{-}$)+c(OH-) | |
| C. | Na2C2O4溶液:c(OH-)=c(H+)+c(HC2O${\;}_{4}^{-}$)+2c(H2C2O4) | |
| D. | CH3COONa和CaCl2混合溶液:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-) |