题目内容
17.下列离子方程式书写错误的是( )| A. | 铝粉投入到NaOH溶液中:2Al+2H2O+2OH-═2AlO2-+3H2↑ | |
| B. | Al(OH)3溶于NaOH溶液中:Al(OH)3+OH-═AlO2-+2H2O | |
| C. | FeCl2溶液跟Cl2反应:2Fe2++Cl2═2Fe3++2Cl- | |
| D. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ |
分析 A.铝与氢氧化钠溶液反应生成偏铝酸钠和氢气;
B.氢氧化铝与氢氧化钠溶液反应生成偏铝酸钠和水;
C.亚铁离子被氯气氧化成铁离子和氯离子;
D.氨水为弱碱,离子方程式中一水合氨不能拆开.
解答 解:A.铝粉投入到NaOH溶液中,反应生成偏铝酸钠和氢气,反应的离子方程式为:2Al+2H2O+2OH-═2AlO2-+3H2↑,故A正确;
B.Al(OH)3溶于NaOH溶液中,反应生成偏铝酸钠和水,反应的离子方程式为:Al(OH)3+OH-═AlO2-+2H2O,故B正确;
C.FeCl2溶液跟Cl2反应生成氯化铁,反应的离子方程式为:2Fe2++Cl2═2Fe3++2Cl-,故C正确;
D.AlCl3溶液中加入足量的氨水,反应生成氯化铵和氢氧化铝沉淀,正确的离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故D错误;
故选D.
点评 本题考查了离子方程式的书写判断,为高考的高频题,题目难度中等,注意掌握离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.下列实验能达到目的是( )
| 实验目的 | 实验步骤 | |
| A | 检验久置的Na2SO3粉末是否变质 | 取样配成溶液,加入盐酸酸化,再加BaCl2溶液,观察是否生成沉淀 |
| B | 检验碘盐中是否含有碘元素 | 取样配成溶液,加入淀粉溶液,观察溶液是否变蓝 |
| C | 检验碳单质与浓硫酸反应的产物 | 将反应生成的气体通过无水硫酸铜粉末、澄清石灰水、品红溶液 |
| D | 探究铁与水在高温下发生反应 | 将水蒸气通过灼热的铁粉看粉末是否变红 |
| A. | A | B. | B | C. | C | D. | D |
8.氢氧化镁是一种用途广泛、极具开发前景的环保材料,广泛应用在阻燃、废水中和、烟气脱硫等方面.镁硅酸盐矿石(主要成分Mg3Si2O5(OH)4,含氧化铝、氧化铁、氧化亚铁等杂质)可用于生产氢氧化镁,简要工艺流程如图1:
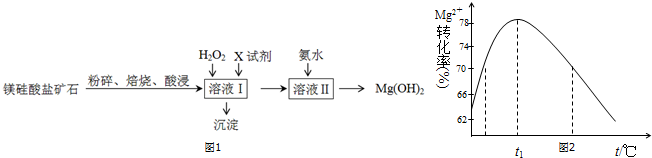
已知:几种金属阳离子的氢氧化物沉淀时的pH如下表所示:
(1)对矿石焙烧的目的是改变矿石结构,提高酸浸率.
(2)加入H2O2溶液反应的离子方程式是2Fe2++H2O2+2H+=2Fe3++2H2O.
(3)向溶液Ⅰ中加入的X可以是MgO或Mg(OH)2、MgCO3,
作用是调节溶液pH.
(4)加入氨水时,Mg2+转化率随温度t的变化如图2所示:
①溶液Ⅱ中发生反应的离子方程式是Mg2++2NH3•H2O=Mg(OH)2↓+2NH4+.
②t1前Mg2+转化率增大的原因是镁离子与氨水反应是吸热反应,升高温度,平衡右移,Mg2+转化率增大;
t1后Mg2+转化率下降的原因是(用化学方程式表示)NH3•H2O$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O.

已知:几种金属阳离子的氢氧化物沉淀时的pH如下表所示:
| Fe3+ | Al3+ | Fe2+ | Mg2+ | |
| 开始沉淀时 | 1.5 | 3.3 | 6.5 | 9.4 |
| 沉淀完全时 | 3.7 | 5.2 | 9.7 | 12.4 |
(2)加入H2O2溶液反应的离子方程式是2Fe2++H2O2+2H+=2Fe3++2H2O.
(3)向溶液Ⅰ中加入的X可以是MgO或Mg(OH)2、MgCO3,
作用是调节溶液pH.
(4)加入氨水时,Mg2+转化率随温度t的变化如图2所示:
①溶液Ⅱ中发生反应的离子方程式是Mg2++2NH3•H2O=Mg(OH)2↓+2NH4+.
②t1前Mg2+转化率增大的原因是镁离子与氨水反应是吸热反应,升高温度,平衡右移,Mg2+转化率增大;
t1后Mg2+转化率下降的原因是(用化学方程式表示)NH3•H2O$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O.
12.化学与科学、技术、社会、环境密切相关,下列说法正确的是( )
| A. | 研制乙醇汽油技术,能够降低机动车尾气中有害气体的排放 | |
| B. | 联合制碱法生产纯碱时,在饱和食盐水中先通入二氧化碳,再通入氨气 | |
| C. | 接触法制备硫酸的过程中,在吸收塔内是用大量的水吸收三氧化硫 | |
| D. | 工业上通过电解熔融氧化铝制备金属铝时,常常加入冰晶石作助熔剂 |
2.羟基扁桃酸是药物合成的重要中间体,它可由苯酚和乙醛酸反应制得,下列有关说法正确的是( )
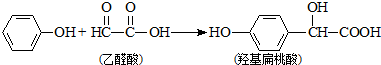
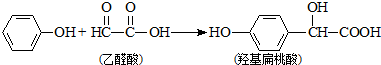
| A. | 苯酚和羟基扁桃酸互为同系物 | |
| B. | 常温下,1mol羟基扁桃酸只能与2molBr2反应发生加成反应 | |
| C. | 羟基扁桃酸分子中至少有12个原子共平面 | |
| D. | 乙醛酸的核磁共振氢谱中只有1个吸收峰 |
9.下列现象或事实可用同一原理解释的是( )
| A. | 浓硫酸和浓盐酸长期暴露在空气中浓度降低 | |
| B. | SO2和FeSO4溶液使酸性高锰酸钾的紫色褪去 | |
| C. | 漂白粉、活性炭、Na2O2都能使红墨水褪色 | |
| D. | 亚硫酸钠溶液和氯化铝溶液在空气中蒸干不能得到对应的溶质 |
6.下列哪种物质可以鉴别乙醇和乙醛( )
| A. | 新制氢氧化铜 | B. | 碳酸钠溶液 | C. | 高锰酸钾溶液 | D. | FeCl3溶液 |
13.下列离子方程式是正确的是( )
| A. | 碳酸氢铵溶液与过量的氢氧化钠溶液反应:NH4++OH-=NH3•H2O | |
| B. | 氢氧化铝与足量盐酸反应:Al(OH)3+3H+=Al3++3H2O | |
| C. | 二氧化硫和规律氢氧化钠溶液:SO2+OH-=HSO3- | |
| D. | 铜片与稀硝酸反应:Cu+NO3-+4H+=Cu2++NO↑+2H2O |
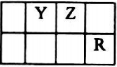 己知X、Y、Z、Q、R是原子序数依次增大的短周期元素,X和Q位于同主族,Y、Z、R在元素周期表中的相对位置如图所示,其中Q与R属于同周期.且R的单质常温下是一种黄绿色气体,X2Z2分子和R-离子具有相同的电子数,请回答:
己知X、Y、Z、Q、R是原子序数依次增大的短周期元素,X和Q位于同主族,Y、Z、R在元素周期表中的相对位置如图所示,其中Q与R属于同周期.且R的单质常温下是一种黄绿色气体,X2Z2分子和R-离子具有相同的电子数,请回答: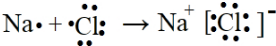 .
.