题目内容
15.下列物质中,制取时不需用石灰石作原料的是( )| A. | 硅酸 | B. | 水泥 | C. | 玻璃 | D. | 生石灰 |
分析 石灰石是重要的工业原料,高炉炼铁、生石灰的制取以及水泥的制取、玻璃的制取都需要使用.
解答 解:A.向硅酸钠溶液中通入二氧化碳可以获得硅酸,不需要石灰石,故A选;
B.水泥生产中需要使用石灰石,故B不选;
C.工业生成玻璃的原料是:石灰石、纯碱和石英,需要使用石灰石,故C不选;
D.碳酸钙高温分解生成氧化钙,故生石灰的制取需要使用石灰石,故D不选;
故选A.
点评 本题考查了石灰石的用途,依据物质的性质即可解答,注意对相关知识的积累.

练习册系列答案
相关题目
5.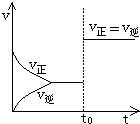 可逆反应aA(g)+bY(g)?cZ(g)在一定温度下的密闭容器内达到平衡后,t0时改变某一外界条件,化学反应速率(v)-时间(t)的图象图如图所示,下列说法正确的是( )
可逆反应aA(g)+bY(g)?cZ(g)在一定温度下的密闭容器内达到平衡后,t0时改变某一外界条件,化学反应速率(v)-时间(t)的图象图如图所示,下列说法正确的是( )
 可逆反应aA(g)+bY(g)?cZ(g)在一定温度下的密闭容器内达到平衡后,t0时改变某一外界条件,化学反应速率(v)-时间(t)的图象图如图所示,下列说法正确的是( )
可逆反应aA(g)+bY(g)?cZ(g)在一定温度下的密闭容器内达到平衡后,t0时改变某一外界条件,化学反应速率(v)-时间(t)的图象图如图所示,下列说法正确的是( )| A. | 只能通过加入催化剂实现 | B. | 可能通过增大压强来实现 | ||
| C. | 可能通过升高温度实现 | D. | a+b一定不等于c |
3.固体粉末X中可能含有FeO、Fe2O3、MnO2、K2SiO3、K2SO3、KAlO2、MgCl2、K2CO3、NaNO2中的若干种.为确定该固体粉末的成分,现取X进行连续实验,实验过程及产物如图.根据实验,以下说法正确的是( )
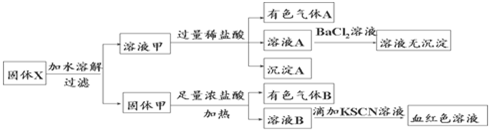

| A. | 溶液甲中一定含有K2SiO3、NaNO2、可能含有KAlO2、K2CO3 一定不含有K2SO3 | |
| B. | 沉淀A为H2SiO3 | |
| C. | 气体A和气体B一定均为纯净物 | |
| D. | 原混合物中一定含有Fe2O3 |
4.下列叙述正确的是( )
| A. | 丙烷分子中3个碳原子一定在同一条直线上 | |
| B. | 丙烯分子中3个碳原子都在同一平面 | |
| C. | 乙烷分子中碳原子和全部氢原子可能在同一平面上 | |
| D. | 2-丁烯分子中4个碳原子在同一平面上 |
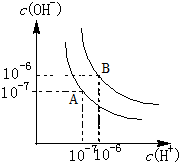 按要求填空:
按要求填空: 实验室配制250mL 0.100mol/L氯化钠溶液:
实验室配制250mL 0.100mol/L氯化钠溶液:
 (R,R′,R″代表相同或不相同的烃基)
(R,R′,R″代表相同或不相同的烃基) .
. .
. .
.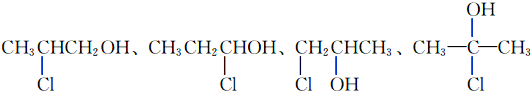 .
.