题目内容
17.为了探究HClO的漂白性,某同学设计如下的实验: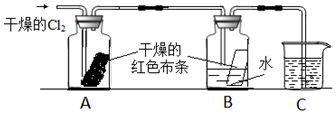
(1)通入氯气后,从集气瓶A中干燥的红色布条的现象可得出的结论是干燥的氯气没有漂白性;从集气瓶B中湿润的红色布条的现象可得出的结论是潮湿的氯气具有漂白性,其中氯气发生反应的化学方程式为Cl2+H2O?HCl+HClO.
(2)烧杯中所盛的试剂为氢氧化钠溶液(或碱溶液),其作用是吸收尾气(或氯气).
分析 Cl2与H2O反应生成HClO,反应的化学方程式为Cl2+H2O=HCl+HClO,具有漂白性的物质为HClO,如确证,可检验盐酸是否能使红布条褪色,干燥的氯气不具有漂白性,不能使干燥有色布条褪色,氯气可与氢氧化钠反应生成氯化钠、次氯酸钠和水,可用于氢氧化钠吸收尾气,以此解答该题.
解答 解:(1)通入Cl2后,干燥的氯气没有漂白性,集气瓶A中干燥的红色布条不褪色,Cl2与H2O反应生成HClO,反应的化学方程式为Cl2+H2O?HCl+HClO,具有漂白性的物质为HClO,则集气瓶B中湿润的红色布条褪色,
故答案为:干燥的氯气没有漂白性;潮湿的氯气具有漂白性;Cl2+H2O?HCl+HClO;
(2)氯气有毒,不能排放在空气中,NaOH溶液所起的作用是吸收多余的氯气,氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水,反应的化学方程式为2NaOH+Cl2═NaCl+NaClO+H2O,故答案为:氢氧化钠溶液(或碱溶液)、吸收尾气(或氯气).
点评 本题考查性质实验方案的设计,为高频考点,把握实验装置的作用、发生的反应、实验设计的分析为解答的关键,注意验证HClO具有漂白性,利用对比和排除干扰的方法来解答,题目难度不大.

练习册系列答案
相关题目
7.下列有关Na2CO3溶液中粒子浓度关系不正确的是( )
| A. | c(H+)+c(Na+)>c(CO32-)+c(HCO3-)+c(OH-) | B. | c(H+)+2c(H2CO3)+c(HCO3-)=c(OH-) | ||
| C. | c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | D. | c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+) |
8.用作调味品的食醋也可用来除水垢,其除垢的有效成分是( )
| A. | 乙醇 | B. | 乙酸 | C. | 葡萄糖 | D. | 乙酸乙酯 |
5.下列条件下,两种气体分子数一定不相等的是( )
| A. | 相同质量、不同密度的N2O 和CO2 | |
| B. | 相同体积、相同密度的CO 和 C2 H4 | |
| C. | 相同温度、相同压强、相同体积的O2和O3 | |
| D. | 相同压强、相同质量的C2H4和C3H6 |
12.下列关于镁及其化合物的叙述错误的是( )
| A. | 镁易与非金属单质O2、Cl2等反应 | B. | 镁在空气中燃烧生成Mg2O和Mg2O2 | ||
| C. | 氢氧化镁是难溶于水的碱 | D. | 氧化镁熔点高,可以作耐高温材料 |
9.分子式为C7H11Cl的有机物,其结构不可能是( )
| A. | 含1个双键的环状有机物 | B. | 含2个双键的直链有机物 | ||
| C. | 只含有1个双键的直链有机物 | D. | 含一个三键的直链有机物 |
6.下列试剂中需要张贴图标志的是( )


| A. | HNO3 | B. | CuO | C. | NaCl | D. | C2H5OH |

 .
. .
.
 (不考虑立体异构)
(不考虑立体异构)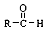 +CH3CHO$\stackrel{稀碱}{→}$
+CH3CHO$\stackrel{稀碱}{→}$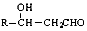 $\stackrel{-H_{2}O}{→}$RCH=CHCHO
$\stackrel{-H_{2}O}{→}$RCH=CHCHO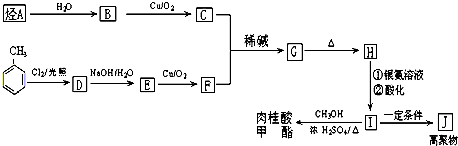

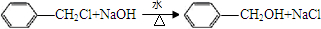
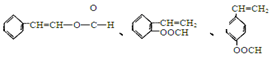
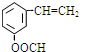 、
、 .
.