题目内容
用Pt作电极,电解串联电路中分装在甲、乙两个烧杯中的100ml 0.4mol/L的NaCl溶液和100ml 0.lmol?L-1的稀硫酸,标况下产生0.224LCl2时停止电解,取出电极,将两烧杯溶液混合并冷却至常温,所得溶液的pH为(设气体产物全部逸出,混合溶液的总体积为200mL )( )
| A、5 | B、6 | C、7 | D、13 |
考点:电解原理,pH的简单计算
专题:电化学专题
分析:两个电解池串联,分别发生的反应为:2NaCl+2H2O
2NaOH+H2↑+Cl2↑、2H2O
2H2+O2↑,根据氯气和氢氧化钠之间的关系式计算氢氧化钠的物质的量,根据氢氧根离子和氢离子的物质的量关系,进而计算混合后溶液的PH..
| ||
| ||
解答:
解:两个烧杯中发生的反应分别为:2NaCl+2H2O
2NaOH+H2↑+Cl2↑、2H2O
2H2+O2↑,生成氯气的物质的量=
=0.01mol,
2NaCl+2H2O
2NaOH+H2↑+Cl2↑;
2 1
n(NaOH) 0.025mol
2:1=n(NaOH):0.01mol,n(NaOH)=0.02mol,根据原子守恒得n(OH-)=0.02mol;
电解稀硫酸溶液实际上是电解水,溶液中硫酸的物质的量不变,n(H+)=0.1mol/L×0.1×2=0.02mol,
两种溶液混合时,酸中氢离子的物质的量等于碱中氢氧根离子的物质的量,所以二者恰好中和,溶液呈中性,pH=7,故选C.
| ||
| ||
| 0.224L |
| 22.4L/mol |
2NaCl+2H2O
| ||
2 1
n(NaOH) 0.025mol
2:1=n(NaOH):0.01mol,n(NaOH)=0.02mol,根据原子守恒得n(OH-)=0.02mol;
电解稀硫酸溶液实际上是电解水,溶液中硫酸的物质的量不变,n(H+)=0.1mol/L×0.1×2=0.02mol,
两种溶液混合时,酸中氢离子的物质的量等于碱中氢氧根离子的物质的量,所以二者恰好中和,溶液呈中性,pH=7,故选C.
点评:本题以电解原理为载体考查了pH的简单计算,根据氯气结合原子守恒计算n(OH-),再结合氢离子和氢氧根离子物质的量的相对大小确定混合溶液酸碱性,注意:不用根据转移电子守恒计算硫酸的物质的量,为易错点.

练习册系列答案
 天天练口算系列答案
天天练口算系列答案
相关题目
下列反应中,属于水解反应的是( )
| A、HCO3-+H2O═H3O++CO32- |
| B、HCO3-+H3O+=2H2O+CO2↑ |
| C、CO2+H2O═H2CO3 |
| D、CO32-+H2O═HCO3-+OH- |
下列各组离子在水溶液中能大量共存并且溶液为无色透明的离子组是( )
| A、K+、HCO3-、CO32-、Br- |
| B、CO32-、HCO3-、OH-、K+ |
| C、Fe3+、Cu2+、NO3-、SO42- |
| D、H+、Cl-、Na+、SO32- |
下列离子方程式书写正确的是( )
| A、硫酸铜溶液中加入过量Ba(OH)2溶液:Ba2++SO42-=BaSO4↓ |
| B、A1Cl3溶液中加过量的NaOH溶液:Al3++3OH-=Al(OH)3↓ |
| C、铜与硝酸银溶液反应:Cu+Ag+=Cu2++Ag |
| D、碳酸钙与过量盐酸反应:CaCO3+2H+=Ca2++CO2↑+H2O |
下列溶液中一定可以大量共存的离子组是( )
| A、pH为2的溶液中:K+、Mg2+、I-、ClO- |
| B、Br-不能大量存在的溶液中:Fe2+、Ca2+、Cl-、NO3- |
| C、(NH4)2Fe(SO4)2?6H2O溶液中:Na+、Cu2+、Cl-、H+ |
| D、NaH2PO4的溶液中:NH4+、K+、HS-、CO32- |

 ,关于它的下列说法正确的是
,关于它的下列说法正确的是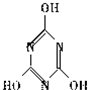 ).三聚氰酸可看成是三分子氰酸通过加成反应得到的环状分子,则氰酸的结构式是
).三聚氰酸可看成是三分子氰酸通过加成反应得到的环状分子,则氰酸的结构式是