题目内容
20.由5molFe2O3、4molFe3O4和3molFeO组成的混合物,加入纯铁1 mol并在高温下和Fe2O3反应.若纯铁完全反应,则反应后混合物中FeO与Fe2O3的物质的量之比可能正确的组合是( )①4:3 ②3:2 ③3:1 ④2:1.
| A. | ②③ | B. | ①② | C. | ①③ | D. | ①④ |
分析 根据在高温下可能发生Fe2O3+Fe$\frac{\underline{\;高温\;}}{\;}$3FeO或4Fe2O3+Fe$\frac{\underline{\;高温\;}}{\;}$3Fe3O4时两种反应,或两种反应同时进行,根据加入铁的物质的量为1mol,结合化学方程式计算可能存在的物质的量的比值.
解答 解:分析题给混合物和高温下发生的反应,可知:
当发生反应:Fe2O3+Fe$\frac{\underline{\;高温\;}}{\;}$3FeO时,反应后混合物中含有6molFeO、4molFe2O3,则FeO与Fe2O3的物质的量之比为3:2;
当发生反应:4Fe2O3+Fe$\frac{\underline{\;高温\;}}{\;}$3Fe3O4时,反应后混合物中含有3molFeO、1molFe2O3,则FeO与Fe2O3的物质的量之比为3:1;
当两反应均存在时,FeO与Fe2O3的物质的量之比处于两者之间,
选项中可能为②③,
故选A.
点评 本题考查了混合物反应的计算,题目难度中等,极端假设法是指根据已知的条件,把复杂问题假设为处于理想的极端状态,站在极端的角度去分析、考虑问题,使其因果关系显得十分明显、简单,从而迅速地作出正确判断的方法,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3. 氢气是合成氨的重要原料,合成氨反应的热化方程式如下:
氢气是合成氨的重要原料,合成氨反应的热化方程式如下:
N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ•mol-1
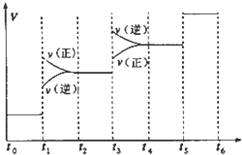
当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如图所示.下列说法正确的是( )
 氢气是合成氨的重要原料,合成氨反应的热化方程式如下:
氢气是合成氨的重要原料,合成氨反应的热化方程式如下:N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ•mol-1
当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如图所示.下列说法正确的是( )
| A. | 图中t1时引起平衡移动的条件可能是升高温度 | |
| B. | 表示平衡混合物中NH3的含量最高的一段时间是t5~t6 | |
| C. | 温度为T℃时,将2amolH2和amolN2放入0.5L密闭容器中,充分反应后测得N2的转化率为50%.则反应的平衡常数为$\frac{16}{{a}_{2}}$ | |
| D. | 在t2~t3时间段,保持容器体积不变,充入一定量的惰性气体,N2的浓度不变 |
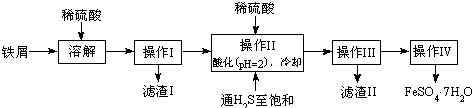
11.绿矾(FeSO4•7H2O)广泛用于工农业生产.下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生成纯净绿矾的一种方法:
查询资料,得有关物质的数据如下表:
(1)操作II中,通入硫化氢至饱和的目的是除去Sn2+并防止Fe2+被氧化;在溶液中用硫酸酸化至pH=2的目的是防止Fe2+沉淀;
(2)操作IV得到的绿矾晶体用少量冰水洗涤,其洗涤的目的是洗去晶体表面的硫酸等杂质;用冰水的原因是降低晶体的溶解度,减少溶解导致FeSO4•7H2O的损耗;
(3)次氯酸盐在碱性条件下氧化硫酸亚铁可得高冷净水剂K2FeO4,离子方程式为2ClO-+Fe2++4OH-=FeO42-+2Cl-+2H2O;
(4)25℃时,将FeSO4•7H2O样品溶于水配成FeSO4溶液,该溶液中的Fe2+在空气中易被氧化成Fe3+,若向完全被氧化后的溶液中滴加NaOH溶液,当滴至溶液的pH=4时,溶液中的c(Fe3+)=4.0×10-8mol/L.[已知该温度下,Fe(OH)3的Ksp=4.0×10-38]
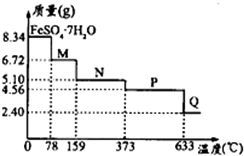
(5)将8.34gFeSO4•7H2O样品隔绝空气加热脱水,其热重曲线(样品质量随温度变化的曲线)如图所示:
①在100℃时M的化学式为FeSO4•4H2O;
②FeSO4•7H2O晶体中有3种不同结合力的水分子.

查询资料,得有关物质的数据如下表:
| 25℃时 | pH值 |
| 饱和H2S溶液 | 3.9 |
| SnS沉淀完全 | 1.6 |
| FeS开始沉淀 | 3.0 |
| FeS沉淀完全 | 5.5 |
(2)操作IV得到的绿矾晶体用少量冰水洗涤,其洗涤的目的是洗去晶体表面的硫酸等杂质;用冰水的原因是降低晶体的溶解度,减少溶解导致FeSO4•7H2O的损耗;
(3)次氯酸盐在碱性条件下氧化硫酸亚铁可得高冷净水剂K2FeO4,离子方程式为2ClO-+Fe2++4OH-=FeO42-+2Cl-+2H2O;
(4)25℃时,将FeSO4•7H2O样品溶于水配成FeSO4溶液,该溶液中的Fe2+在空气中易被氧化成Fe3+,若向完全被氧化后的溶液中滴加NaOH溶液,当滴至溶液的pH=4时,溶液中的c(Fe3+)=4.0×10-8mol/L.[已知该温度下,Fe(OH)3的Ksp=4.0×10-38]
(5)将8.34gFeSO4•7H2O样品隔绝空气加热脱水,其热重曲线(样品质量随温度变化的曲线)如图所示:
①在100℃时M的化学式为FeSO4•4H2O;
②FeSO4•7H2O晶体中有3种不同结合力的水分子.

8. 甲溶液中含Aa+离子浓度为0.10mol/L,乙溶液含Bb-离子浓度为0.35mol/L,取不同体积甲、乙两溶液的物质的量如图所示.则沉淀物的化学式为( )
甲溶液中含Aa+离子浓度为0.10mol/L,乙溶液含Bb-离子浓度为0.35mol/L,取不同体积甲、乙两溶液的物质的量如图所示.则沉淀物的化学式为( )
 甲溶液中含Aa+离子浓度为0.10mol/L,乙溶液含Bb-离子浓度为0.35mol/L,取不同体积甲、乙两溶液的物质的量如图所示.则沉淀物的化学式为( )
甲溶液中含Aa+离子浓度为0.10mol/L,乙溶液含Bb-离子浓度为0.35mol/L,取不同体积甲、乙两溶液的物质的量如图所示.则沉淀物的化学式为( )| A. | A2B3 | B. | A3B2 | C. | AB2 | D. | A2 |
15.碳酸二甲酯(DMC)是一种无毒、环保性能优异、用途广泛的化工原料.在催化剂作用下,可由甲醇和CO2直接合成碳酸二甲酯:C02+2CH3OH→CO(OCH3)2+H2O.某研究小组在其他条件不变的情况下,通过研究催化剂用量分别对转化数(TON ) 的影响来评价催化剂的催化效果.计算公式为TON=转化的甲醇的物质的量/催化剂的物质的量.根据该研究小组的实验及催化剂用量TON的影响图,判断下列说法不正确的是( )

| A. | 由甲醇和CO2直接合成碳酸二甲酯,可以利用价廉易得的甲醇把影响环境的温室气体CO2转化为资源,在资源循环利用和环境保护方面都具有重要意义 | |
| B. | 在反应体系中添加合适的吸水剂,将提高该反应的TON | |
| C. | 当催化剂用量为1.2×10-5mol时,该反应的TON 达到最高点 | |
| D. | 当催化剂用量高于1.2×10-5mol时,随着催化剂用量的增加,甲醇的平衡转化率逐渐降低 |
5.由下列实验事实得出的结论正确的是( )
| A. | 由SiO2不能与水反应生成H2SiO3,可知SiO2不是H2SiO3的酸酐 | |
| B. | 由SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,可知碳的非金属性大于硅 | |
| C. | CO2通入Na2SiO3溶液产生白色沉淀,可知酸性H2CO3>H2SiO3 | |
| D. | SiO2可与NaOH溶液反应,也可与氢氟酸反应,可知SiO2为两性氧化物 |
10.如果25℃时,Kw=1.0×10-14,100℃下Kw=1.0×10-12.下列说法错误的是( )
| A. | 100℃下水的电离程度较大 | B. | 前者的C(H+)较后者小 | ||
| C. | 水的电离过程是一个放热过程 | D. | 温度越高,Kw越大 |
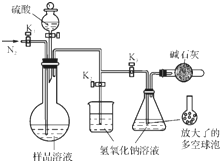 碳酸钠-过氧化氢加合物(aNa2CO3•bH2O2)具有漂白、杀菌作用.实验室用“醇析法”制备该物质的实验步骤如下:
碳酸钠-过氧化氢加合物(aNa2CO3•bH2O2)具有漂白、杀菌作用.实验室用“醇析法”制备该物质的实验步骤如下: 清洁能源具有广阔的开发和应用前景,可减少污染解决雾霾问题,其中甲醇、甲烷是优质的清洁燃料,可制作燃料电池.
清洁能源具有广阔的开发和应用前景,可减少污染解决雾霾问题,其中甲醇、甲烷是优质的清洁燃料,可制作燃料电池.