题目内容
7.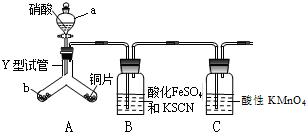 为探究铜与6mol•L-1硝酸反应的气态产物中是否含NO2,进行如下实验.
为探究铜与6mol•L-1硝酸反应的气态产物中是否含NO2,进行如下实验.已知:FeSO4+NO?[Fe(NO)]SO4(棕色),该反应较缓慢,待生成一定量[Fe(NO)]2+时突显明显棕色.
(1)实验前需检验装置的气密性,简述操作关闭分液漏斗活塞,用酒精灯加热Y试管,观察到BC导管口有气泡产生,停止加热,BC长导管到吸入一段水柱,则装置气密性良好.
(2)仪器a的名称分液漏斗
(3)实验开始时先将Y形试管向盛有块状固体b的支管倾斜,缓慢滴入稀硝酸,该实验操作的目的是利用生成的CO2将整个装置内的空气赶尽,避免NO和O2反应生成NO2对气体产物的观察产生干扰;
(4)证明有NO2的实验现象利用生成的CO2将整个装置内的空气赶尽,避免NO和O2反应生成NO2对气体产物的观察产生干扰
(5)装置C的作用吸收尾气NO,反应离子方程式5NO+3MnO4-+4H+=5NO3-+3Mn2++2H2O.
(6)测定化学试剂绿矾(FeSO4•7H2O)纯度的方法:称取绿矾3.000g置于锥形瓶中,加入100mL蒸馏水,加入10mLH2SO4和5mLH3PO4,用0.1000molL-1KMnO4溶液滴定至终点,消耗KMnO4溶液20.00mL.KMnO4溶液盛放在棕色酸式(填“酸”或“碱”)滴定管中,列式计算绿矾的纯度$\frac{5×0.002mol×278g/mol}{3.000g}$×100%=92.67%.
分析 (1)根据压强差进行装置气密性的检验;
(2)根据装置图可知仪器A的名称;
(3)实验开始时先将Y形试管向盛有碳酸钙的支管倾斜,缓慢滴入稀硝酸,碳酸钙与稀硝酸生成CO2,将整个装置内的空气赶尽,避免NO和O2反应生成NO2对气体产物的观察产生干扰;
(4)本实验生成的气体中,若有NO2,NO2溶于水生成硝酸,把Fe2+氧化成Fe3+,B瓶溶液出现血红色;
(5)高锰酸钾溶液能将一氧化氮氧化成硝酸根,而防止其污染空气;
(6)高锰酸钾溶液有强氧化性,应用酸式滴定管中进行滴定,根据电子得失守恒可知关系式5FeSO4•7H2O~2KMnO4,根据关系式由高锰酸钾的物质的量可计算得FeSO4•7H2O的质量,进而确定其纯度;
解答 解:(1)根据压强差进行装置气密性的检验,具体方法为:关闭分液漏斗活塞,用酒精灯加热Y试管,观察到BC导管口有气泡产生,停止加热,BC长导管到吸入一段水柱,则装置气密性良好;
故答案为:关闭分液漏斗活塞,用酒精灯加热Y试管,观察到BC导管口有气泡产生,停止加热,BC长导管到吸入一段水柱,则装置气密性良好;
(2)根据装置图可知仪器A的名称为分液漏斗,
故答案为:分液漏斗;
(3)实验开始时先将Y形试管向盛有碳酸钙的支管倾斜,缓慢滴入稀硝酸,碳酸钙与稀硝酸生成CO2,将整个装置内的空气赶尽,避免NO和O2反应生成NO2对气体产物的观察产生干扰,
故答案为:利用生成的CO2将整个装置内的空气赶尽,避免NO和O2反应生成NO2对气体产物的观察产生干扰;
(4)本实验生成的气体中,若有NO2,NO2溶于水生成硝酸,把Fe2+氧化成Fe3+,B瓶溶液出现血红色;若无二氧化氮则无血红色,所以证明有NO2的实验现象是铜与硝酸反应不久即观察到B中溶液呈红色,
故答案为:铜与硝酸反应不久即观察到B中溶液呈红色;
(5)高锰酸钾溶液能将一氧化氮氧化成硝酸根,而防止其污染空气,反应的离子方程式为5NO+3MnO4-+4H+=5NO3-+3Mn2++2H2O,
故答案为:吸收尾气NO;5NO+3MnO4-+4H+=5NO3-+3Mn2++2H2O;
(6)高锰酸钾溶液有强氧化性,应用酸式滴定管中进行滴定,滴定中消耗的高锰酸钾的物质的量为0.1000molL-1×0.02L=0.002mol,根据电子得失守恒可知关系式5FeSO4•7H2O~KMnO4,所以样品中FeSO4•7H2O的质量为5×0.002mol×278g/mol,所以绿矾的纯度为$\frac{5×0.002mol×278g/mol}{3.000g}$×100%=92.67%,
故答案为:酸;$\frac{5×0.002mol×278g/mol}{3.000g}$×100%=92.67%.
点评 本题考查了铜和硝酸的反应实验,探究铜与稀硝酸反应的产物及绿矾纯度的计算,对比、对照分析及应用电子得失守恒是解题的关键,题目难度中等.

 中考解读考点精练系列答案
中考解读考点精练系列答案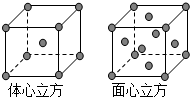 Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:| 元 素 | Mn | Fe | |
| 电离能 /kJ•mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
(1)Fe元素价电子层的电子排布式为3d64s2,比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难.对此,你的解释是由Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转为不稳定的3d4状态需要的能量较多,而Fe2+到Fe3+时,3d能级由不稳定的3d6到稳定的3d5半充满状态,需要的能量相对要少;
(2)Fe原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物.
①与Fe原子或离子形成配合物的分子或离子应具备的结构特征是具有孤对电子;
②六氰合亚铁离子(Fe(CN)64-)中的配体CN-中C原子的杂化轨道类型是sp;
(3)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华.易溶于水,也易溶于乙醚、丙酮等有机溶剂.据此判断三氯化铁晶体为分子晶体;
(4)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示.面心立方晶胞和体心立方晶胞中实际含有的Fe原子个数之比为2:1.
| A. | 2mLNO | B. | 8mLNO2和4mLO2 | C. | 2mLO2 | D. | 0.25mLO2 |
| A. | ①>②>③ | B. | ③>②>① | C. | ②>③>① | D. | ②>①>③ |

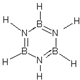 ,其结构和物理性质和苯相似,称为“无机苯”,该物质的二氯代物有4种.
,其结构和物理性质和苯相似,称为“无机苯”,该物质的二氯代物有4种.