题目内容
5.用NA表示阿伏伽德罗常数的数值,下列叙述正确的是( )| A. | 常温下,1mol丙烯中含碳原子数为3NA | |
| B. | 常温下,pH=13的NaOH溶液中含OH-数目为NA | |
| C. | 23gNa与足量氧气反应时转移的电子数为2NA | |
| D. | 标准状况下,22.4LCHCl3中含C-H键数目为NA |
分析 A、丙烯的分子式为C3H6;
B、溶液的体积不明确;
C、求出钠的物质的量,然后根据钠反应后的价态来分析;
D、标况下,三氯甲烷为液态.
解答 解:A、丙烯的分子式为C3H6,故1mol丙烯含3mol碳原子,故A正确;
B、溶液的体积不明确,故溶液中氢氧根的个数无法计算,故B错误;
C、23g钠的物质的量为1mol,而钠反应后的价态为+1价,故1mol钠转移1mol电子,故C错误;
D、标况下,三氯甲烷为液态,故不能根据气体摩尔体积来计算其物质的量,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目
8.下列结论是从某同学的笔记本上摘录的,你认为其中肯定正确的是( )
①微粒半径Cl->S2->S>F ②氢化物的稳定性 HF>HCl>H2S>H2Se ③还原性S2->Cl->Br->I- ④氧化性 Cl2>S>Se>Te ⑤酸性 H2SO4>HClO4>H2SeO4 ⑥得电子能力F>Cl>Br>I.
①微粒半径Cl->S2->S>F ②氢化物的稳定性 HF>HCl>H2S>H2Se ③还原性S2->Cl->Br->I- ④氧化性 Cl2>S>Se>Te ⑤酸性 H2SO4>HClO4>H2SeO4 ⑥得电子能力F>Cl>Br>I.
| A. | 只有① | B. | ①③④ | C. | ②④⑥ | D. | 只有⑥ |
13.下列分子中的所有碳原子不可能处在同一平面上的是( )
① ②
② ③
③ ④
④ ⑤CH3CH=CHCH3.
⑤CH3CH=CHCH3.
①
 ②
② ③
③ ④
④ ⑤CH3CH=CHCH3.
⑤CH3CH=CHCH3.| A. | ②③ | B. | ①④ | C. | ①②④ | D. | ①⑤ |
20.下列有关的实验操作、现象和解释或结论都正确的是( )
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 无色溶液中滴加氯水和CCl4,振荡、静置 | 上层溶液显紫色 | 原溶液中有I- |
| B | 将SO2通入酸性KMnO4溶液中 | 紫色褪去 | SO2具有还原性 |
| C | 向明矾溶液中通入过量氨气 | 先产生大量白色沉淀,后沉淀逐渐消失 | Al(OH)3能溶于氨水 |
| D | AgI沉淀中滴入浓KCl溶液 | 有白色沉淀出现 | 溶解度:AgCl<AgI |
| A. | A | B. | B | C. | C | D. | D |
10.运用化学反应原理研究NH3的性质具有重要意义.请回答下列问题:
(1)利用对苯醌质子电池可检测氨气,其电池反应原理为2NH3+ (对苯醌)═N2H4+
(对苯醌)═N2H4+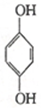 (对苯酚),N2H4的结构式为
(对苯酚),N2H4的结构式为 ,该电池正极的电极反应式为
,该电池正极的电极反应式为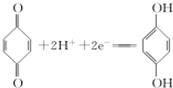 .
.
(2)25℃时,将nmol•L-1的氨水与0.1mol•L-1的盐酸等体积混合.
①若混合溶液中c(NH4+)=c(Cl-),则溶液的pH=7.
②若混合溶液中c(NH4+)>c(Cl-),则反应的情况可能为a.
a、盐酸不足,氨水剩余 b、氨水与盐酸恰好反应 c、盐酸过量
(3)在0.5L恒容密闭容器中,一定量的N2与H2进行反应:N2(g)+3N2(g)?2NH3(g)△H=bkJ•mol-1,其化学平衡常数K与温度的关系如下:
①写出该反应的化学平衡常数的表达式:$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$,b小于(填“大于”“小于”或“等于”)0.
②400℃时,测得某时刻氨气、氮气、氢气的物质的量分别为3mol、2mol、1mol时,此时刻该反应的u正(N2)小于(填“大于”“小于”或“等于”)u正(N2).
(4)已知:①4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H=-1266.8kJ•mol-1
②N2(g)+O2(g)═2NO(g)△H=+180.5kJ•mol-1
写出氨高温催化氧化的热化学方程式:4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-905.8KJ/mol.
(1)利用对苯醌质子电池可检测氨气,其电池反应原理为2NH3+
 (对苯醌)═N2H4+
(对苯醌)═N2H4+ (对苯酚),N2H4的结构式为
(对苯酚),N2H4的结构式为 ,该电池正极的电极反应式为
,该电池正极的电极反应式为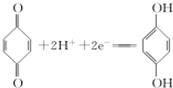 .
.(2)25℃时,将nmol•L-1的氨水与0.1mol•L-1的盐酸等体积混合.
①若混合溶液中c(NH4+)=c(Cl-),则溶液的pH=7.
②若混合溶液中c(NH4+)>c(Cl-),则反应的情况可能为a.
a、盐酸不足,氨水剩余 b、氨水与盐酸恰好反应 c、盐酸过量
(3)在0.5L恒容密闭容器中,一定量的N2与H2进行反应:N2(g)+3N2(g)?2NH3(g)△H=bkJ•mol-1,其化学平衡常数K与温度的关系如下:
| 温度/℃ | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
②400℃时,测得某时刻氨气、氮气、氢气的物质的量分别为3mol、2mol、1mol时,此时刻该反应的u正(N2)小于(填“大于”“小于”或“等于”)u正(N2).
(4)已知:①4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H=-1266.8kJ•mol-1
②N2(g)+O2(g)═2NO(g)△H=+180.5kJ•mol-1
写出氨高温催化氧化的热化学方程式:4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-905.8KJ/mol.
17.生活中处处有化学,下列叙述错误的是( )
| A. | 用燃烧法可鉴别羊毛制品相涤纶制品 | |
| B. | 保鲜膜、一次性食品袋的主要成分是聚氯乙烯 | |
| C. | 严禁乱弃废电池,防止重金属污染土壤和水源 | |
| D. | 某些食品的包装袋内常放人一小包生石灰作干燥剂 |
14.下列图示实验正确的是( )
| A. |  | B. |  | C. |  | D. |  |
15.某Na2CO3、NaAlO2的混合溶液中逐滴加入1mol•L-1的盐酸,测得溶液中的HCO3-、CO32-、AlO2-、Al3+离子的物质的量与加入盐酸溶液的体积变化关系如图所示,则下列说法正确的是( )

| A. | 原混合溶液中的CO32-与AlO2-的物质的量之比为1:2 | |
| B. | V1:V2=l:5 | |
| C. | M点时生成的CO2为0.05mol | |
| D. | e曲线表示的离子方程式为:Al(OH)3+3H+=Al3++3H2O |
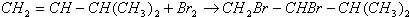 ;
;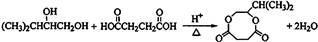 .
.