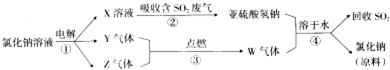
题目内容
10.运用化学反应原理研究NH3的性质具有重要意义.请回答下列问题:(1)利用对苯醌质子电池可检测氨气,其电池反应原理为2NH3+
 (对苯醌)═N2H4+
(对苯醌)═N2H4+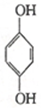 (对苯酚),N2H4的结构式为
(对苯酚),N2H4的结构式为 ,该电池正极的电极反应式为
,该电池正极的电极反应式为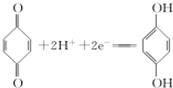 .
.(2)25℃时,将nmol•L-1的氨水与0.1mol•L-1的盐酸等体积混合.
①若混合溶液中c(NH4+)=c(Cl-),则溶液的pH=7.
②若混合溶液中c(NH4+)>c(Cl-),则反应的情况可能为a.
a、盐酸不足,氨水剩余 b、氨水与盐酸恰好反应 c、盐酸过量
(3)在0.5L恒容密闭容器中,一定量的N2与H2进行反应:N2(g)+3N2(g)?2NH3(g)△H=bkJ•mol-1,其化学平衡常数K与温度的关系如下:
| 温度/℃ | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
②400℃时,测得某时刻氨气、氮气、氢气的物质的量分别为3mol、2mol、1mol时,此时刻该反应的u正(N2)小于(填“大于”“小于”或“等于”)u正(N2).
(4)已知:①4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H=-1266.8kJ•mol-1
②N2(g)+O2(g)═2NO(g)△H=+180.5kJ•mol-1
写出氨高温催化氧化的热化学方程式:4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-905.8KJ/mol.
分析 (1)肼相当于氨气分子中一个氢原子被氨基取代;
该电池正极上 得到电子生成
得到电子生成 ;
;
(2)①根据电荷守恒及c(Cl-)=c(NH4+)判断溶液中氢离子浓度和氢氧根离子浓度相对大小,从而确定溶液的酸碱性,得出正确结论;
②根据电荷守恒及c(Cl-)<c(NH4+)判断溶液中氢离子浓度和氢氧根离子浓度相对大小,从而确定溶液的酸碱性,得出正确结论;
(3)①根据平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,书写平衡常数表达式,分析平衡常数随温度变化,结合平衡移动原理分析反应热量变化情况;
②依据浓度商和平衡常数的比较,判断反应进行的方向;
(4)①4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H=-1266.8kJ•mol-1
②N2(g)+O2(g)═2NO(g)△H=+180.5kJ•mol-1,
利用盖斯定律进行计算,由①+2×②得出正确结论.
解答 解:(1)肼中相当于氨气分子中一个氢原子被氨基取代,所以肼的结构式为 ;
;
该电池正极上 得到电子生成
得到电子生成 ,电极反应式为:
,电极反应式为: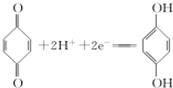 ,
,
故答案为: ;
;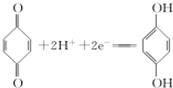 ;
;
(2)①根据电荷守恒得:c(Cl-)+c(OH-)=c(NH4+)+c(H+),溶液中c(Cl-)=c(NH4+),所以c(OH-)=c(H+),所以溶液呈中性,即pH=7,
故答案为:7;
②根据电荷守恒得:c(NH4+)+c(H+)=c(OH-)+c(Cl-),当c(NH4+)>c(Cl-)时,则c(H+)<c(OH-),溶液呈碱性;
a.盐酸不足,氨水剩余,溶液显碱性,与题意相符,故a可选;
b.氨水与盐酸恰好反应,生成氯化铵,铵根离子水解显酸性,与题意不符,故b不选;
c.盐酸过量,溶液呈酸性,与题意不符,故c不选;
故答案为:a;
(3)①N2(g)+3H2(g)?2NH3(g)△H=bkJ•mol-1,平衡常数K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$,
由表中数据可知:平衡常数随温度升高而减小,说明升高温度,平衡逆向进行,逆向是吸热反应,故正反应为放热反应,故b小于0,
故答案为:$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$;小于;
②400°C N2(g)+3H2(g)?2NH3(g)的K=0.5,400℃时,测得氨气、氮气、氢气的物质的量分别为3mol、2mol、1mol时,浓度分别为$\frac{3}{0.5}$=6mol/L,$\frac{2}{0.5}$=4mol/L,$\frac{1}{0.5}$=2mol/L,Qc=$\frac{{6}^{2}}{4×{2}^{3}}$=1.1>K,说明平衡逆向进行,v正(N2)<v逆(N2);
故答案为:小于;
(4)①4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H=-1266.8kJ•mol-1
②N2(g)+O2(g)═2NO(g)△H=+180.5kJ•mol-1,
由①+2×②可得:4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=(-1266.8kJ•mol-1)+(+180.5kJ•mol-1)=-905.8KJ/mol,
故答案为:4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-905.8KJ/mol.
点评 本题考查的知识点较多,涉及结构式、电极反应式的书写,溶液中离子浓度大小的判断,平衡常数的计算和化学平衡移动原理,以及盖斯定律的应用,综合性较强,浓度较大.要注意掌握根据浓度商和平衡常数的比较,判断反应进行的方向.

| A. | 二氧化氮不是硝酸的酸酐 | |
| B. | 二氧化氮与水的反应是氧化还原反应 | |
| C. | 二氧化氮不是造成大气污染的气体之一 | |
| D. | 在通常状况下测得的NO2的相对分子质量是不准确的 |
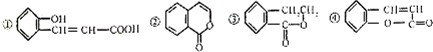
| A. | 只有①能和碳酸钠反应放出气体 | B. | ②和④互为同分异构体 | ||
| C. | ①②④都可以使溴水褪色 | D. | ④与H2加成后可以得到③ |
| A. | 常温下,1mol丙烯中含碳原子数为3NA | |
| B. | 常温下,pH=13的NaOH溶液中含OH-数目为NA | |
| C. | 23gNa与足量氧气反应时转移的电子数为2NA | |
| D. | 标准状况下,22.4LCHCl3中含C-H键数目为NA |

以下说法正确的是( )
| A. | 白色沉淀甲是Al(OH)3,气体甲是CO2,原混合物中一定含有Al3+和HCO3- | |
| B. | 白色沉淀乙是BaSO4,原混合物中一定含有SO42- | |
| C. | 气体乙一定是NO和NO2的混合气体 | |
| D. | 原混合物中一定含有Na+、Al3+、NO3-、SO32- |
| 选项 | 离子或分子 | 要求 |
| A | Mg2+、SO42-、Cl-、NO3- | c(Mg2+)=c(SO42-) |
| B | Na+、Cu2+、I-、NH3•H2O | 在酸性高锰酸钾溶液中 |
| C | NH4+、Al3+、Cl-、NO3- | 滴加氨水有沉淀产生 |
| D | Cl-、Na+、Cr2O72-、C2H5OH | 溶液无色透明且遇甲基橙显红色 |
| A. | A | B. | B | C. | C | D. | D |
 .
.