题目内容
8.化学与社会经济建设、生态文明建设、人类健康保障等密切相关.(1)材料是社会经济建设的重要物质基础.
①生产硅酸盐水泥和普通玻璃都需用到的共同原料是石灰石(或CaCO3).
②橡胶是制造轮胎的重要原料,橡胶属于c(填字母).
a.金属材料 b.无机非金属材料 c.有机高分子材料
③炒过菜的铁锅易生锈是因为发生了吸氧腐蚀(填“吸氧”或“析氢”).发生该腐蚀时的正极反应式为O2+4e-+2H2O=4OH-.
(2)防治环境污染,改善生态环境已成为全球共识.
①近来全国多个省市出现严重的雾霾天气.导致雾霾形成的主要污染物是c(填字母).
a.O2 b.CO2 c.PM2.5
②采用焚烧处理垃圾进行发电已在江苏投入使用.在焚烧处理前,下列垃圾应剔除并回收的有ac(填字母).
a.废电池 b.枯树枝 c.废弃塑料
③工业废水需处理达标后才能排放.下列废水处理的方法合理的是a(填字母).
a.用中和法除去废水中的酸
b.用混凝剂除去废水中的重金属离子
c.用氯气除去废水中的悬浮物
④漂白粉可用于生活用水的杀菌消毒,工业上利用氯气和石灰乳制取漂白粉的化学反应方程式是2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O.
(3)保证食品安全、保持营养均衡,是保障人体健康的基础.
①维生素C能促进人体生长发育.下列富含维生素C的是b(填字母).
a.牛肉 b.辣椒 c.鸡蛋
②缺乏某种微量元素将导致甲状腺肿大,且造成智力损害,该微量元素是a(填字母).
a.碘 b.铁 c.钙
③人体内蛋白质在蛋白酶作用下,水解为氨基酸,在鸡蛋清溶液中加入饱和硫酸铵溶液有沉淀析出的过程称为盐析.
④使用青霉素可能会产生过敏,在用药前患者一定要进行皮试.
分析 (1)①水泥的原料是粘土和石灰石,玻璃的原料是纯碱、石灰石和石英,所以原料中均有石灰石;
②橡胶有天然的和人工合成的,都是高分子材料;
③钢铁是铁的合金易发生电化学腐蚀;正极上氧气得电子;
(2)①PM2.5”是指大气层中直径≥2.5μm的颗粒物,能被肺吸收并进入血液,对人体危害很大,是形成雾霾的主要污染物;
②不能燃烧的垃圾,不能采用焚烧处理;
③混凝剂适用于除去废水中的悬浮物;沉淀法适用于除去废水中的重金属离子;中和法适用于除去废水中的酸;
④氯气和石灰乳反应生成氯化钙、次氯酸钙、水;
(3)①蔬菜中富含维生素C;
②碘元素被称为智力元素;
③蛋白质水解生成氨基酸,蛋白质能发生盐析;
④部分抗生素会产生不良反应要做皮试.
解答 解:(1)①生产玻璃的原料是纯碱、石灰石和石英,高温下,碳酸钠、碳酸钙和二氧化硅反应分别生成硅酸钠、硅酸钙;
生产水泥以黏土和石灰石为主要原料,经研磨、混合后在水泥回转窑中煅烧,再加入适量石膏,并研成细粉就得到普通水泥;所以在玻璃工业、水泥工业中都用到的原料是石灰石,故答案为:石灰石(或CaCO3);
②橡胶分为天然橡胶和合成橡胶,天然橡胶的成分是聚异戊二烯 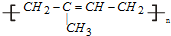 ,合成橡胶主要指:顺丁橡胶、氯丁橡胶、丁苯橡胶等,都为有机高分子材料,故答案为:c;
,合成橡胶主要指:顺丁橡胶、氯丁橡胶、丁苯橡胶等,都为有机高分子材料,故答案为:c;
③钢铁是铁的合金在潮湿的空气中易发生吸氧腐蚀;正极上氧气得电子被还原,其电极反应为:O2+4e-+2H2O=4OH-;
故答案为:吸氧;O2+4e-+2H2O=4OH-;
(2)①导致雾霾形成的主要污染物是pM2.5,能被肺吸收并进入血液,对人体危害很大,故选c;
②电池中的重金属能污染环境,所以不能随意丢弃电池,废弃塑料不能焚烧,否则会导致环境污染,产生大量有害气体;
故答案为:ac;
③a.和法适用于除去废水中的酸,所以用中和法除去废水中的酸,故a正确;
b.用沉淀法除去废水中的重金属离子,故b错误;
c.用混凝剂如明矾等除去废水中的悬浮物,氯气能消毒杀菌,但不能除去悬浮物,故c错误;
故答案为:a;
④氯气和石灰乳反应生成氯化钙、次氯酸钙、水,该反应为2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O,故答案为:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O;
(3)①蔬菜中富含维生素C,所以富含维生素C的是辣椒,故答案为:b;
②碘元素被称为智力元素,缺乏碘元素将导致甲状腺肿大,且造成智力损害,故答案为:a;
③蛋白质在一定条件下水解生成氨基酸,在蛋白质溶液中加入饱和硫酸铵溶液能发生盐析,即有白色沉淀析出,故答案为:氨基酸;盐析;
④部分抗生素会产生不良反应要做皮试,所以使用青霉素前使用者一定要进行皮肤敏感试验,故答案为:皮试.
点评 本题考查常见的环境污染物、漂白粉的制备和药物的主要成分和疗效等,为高频考点,难度不大,注意知识的积累,本题注重化学与生活的联系,明确化学服务于生活,学会利用化学知识解决生活中的问题.

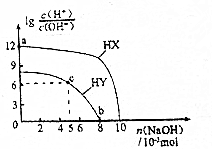
| A. | HX的酸性弱于HY | |
| B. | a点由水电离出的c(H+)=10-12mol•L-1 | |
| C. | c点溶液中:c(Y-)>c(HY) | |
| D. | b点时酸碱恰好完全中和 |

| A. | 乙池中CuSO4溶液的浓度不变 | |
| B. | 甲池中理论上消耗标准状况下空气的体积是2.8L(空气中O2体积分数以20%计算) | |
| C. | 甲池是电能转化为化学能的装置,乙池是化学能转化为电能的装置 | |
| D. | 甲池中通入CH3OH一极的电极反应为CH3OH-6e-+2H2O═CO32-+8H+ |
| A元素的核外电子数和电子层数相等 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能如下: |
| I1=738kJ•mol-1 I2=1451kJ•mol-1 I3=7733kJ•mol-1 I4=10540kJ•mol-1 |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
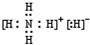 .
.(2)B元素基态原子中能量最高的电子,其电子云在空间有3个方向,原子轨道呈哑铃形.
(3)某同学根据上述信息,推断C基态原子的核外电子排布图为
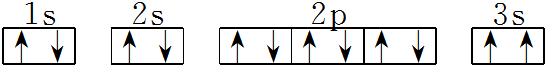 该同学所画的电子排布图违背了泡利原理.
该同学所画的电子排布图违背了泡利原理.(4)G位于ⅦB族d区,该元素的核外电子排布式为1s22s22p63s23p63d54s2.
(5)检验F元素的实验方法是焰色反应.
| A. | 1mol NH4+和1mol OH-所含电子数均为10NA | |
| B. | 14gC2H4和14gC3H6 所含原子数均为3NA | |
| C. | 1L l mol/LH2SO4溶液与足量Zn充分反应生成22.4L H2 | |
| D. | 标准状况下,11.2LSO3所含分子数为0.5NA |

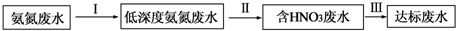

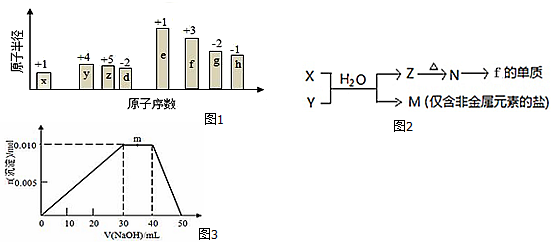
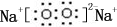 ;B是常见的液态化合物,其稀溶液易被催化分解,可使用的催化剂为AB.(填序号)
;B是常见的液态化合物,其稀溶液易被催化分解,可使用的催化剂为AB.(填序号)