题目内容
5.氯、硫、氦元素广泛存在于自然界中,对人类生命和生活具有重要意义.(1)氯气的颜色黄绿色.
(2)浓硫酸具有:①酸性 ②强氧化性 ③吸水性 ④脱水性,下列现象硫酸所表现出的性质为(填编号)干燥氧气③,使甘蔗变黑④,吸收氨气①;与铜反应①和②,该反应的化学方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(3)为了提高农作物的产量,德国化学家哈伯、波施等成功地开发了将氮气转化为氨气的生产工艺.请用化学方程式表示工业合成氨的反应原理N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3;实验室制取氨气的化学方程式:Ca(OH)2+2NH4Cl $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
(4)自然界形成NO的化学方程式:2NO+O2$\frac{\underline{\;放电\;}}{\;}$2NO2.氢氧化物(NO和NO2)污染环境.若用Na2CO3溶液吸收NO2可生成CO2,9.2g NO2和Na2CO3溶液完全反应时 转移电子0.1mol,则反应的离子方程式为2NO2+CO32-=NO3-+NO2-+CO2.
分析 (1)氯气的物理性质分析,氯气是一种黄绿色有刺激性气味的有毒气体;
(2)浓硫酸具有酸性生成盐,具有强氧化性硫元素化合价+6价变化为+4价,具有吸水性可以吸收气体中的水蒸气,具有脱水性可以使含碳、氢、氧元素的物质中氢元素原子和氧元素原子以2:1脱去,铜和浓硫酸加热反应生成硫酸铜、二氧化硫和水;
(3)工业合成氨的原料为氢气和氮气;实验室用氯化铵和熟石灰的固体混合物加热来制取氨气;
(4)自然界形成一氧化氮是利用空气中的氮气和氧气放电反应生成,若每2mol NO2和Na2CO3溶液反应时转移电子1mol计算生成的硝酸,根据化合价的变化判断生成物,以此书写反应的离子方程式.
解答 解:(1)氯气是一种黄绿色气体,H2在Cl2中燃烧反应生成氯化氢气体,故答案为:黄绿色;
(2)浓硫酸具有:①酸性 ②强氧化性 ③吸水性 ④脱水性,下列现象硫酸所表现出的性质为:干燥氧气是利用浓硫酸的③吸水性,使甘蔗变黑是利用浓硫酸的④脱水性,氨气是碱性气体,浓硫酸吸收氨气利用的是浓硫酸的①酸性,与铜反应生成硫酸铜、二氧化硫和水,反应娥化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,反应中体现了浓硫酸的①酸性 ②强氧化性,
故答案为:③;④;①;①和②;Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(3)工业合成氨的原料为氢气和氮气,发生反应为:N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3,实验室是利用氯化铵和熟石灰的固体混合物加热来制取氨气,反应为:Ca(OH)2+2NH4Cl $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,故答案为:N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3;Ca(OH)2+2NH4Cl $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(4)自然界中氮气和氧气在放电条件下反应生成一氧化氮气体,反应的化学方程式为:2NO+O2=2NO2,9.2g NO2的物质的量为,每2molNO2和Na2CO3溶液反应时转移电子1mol,则N的化合价分别有+4价变化为+5价和+3价,在碱性溶液中应生成NO3-和NO2-,反应的离子方程式为:2NO2+CO32-=NO3-+NO2-+CO2,
故答案为:2NO+O2$\frac{\underline{\;放电\;}}{\;}$2NO2;2NO2+CO32-=NO3-+NO2-+CO2.
点评 本题考查了氯气、浓硫酸、氮氧化物性质的应用,注意浓硫酸的特征性质分析和反应现象、反应产物的判断,题目难度中等.

| A. | 该溶液中肯定不含Ba2+ | |
| B. | 该溶液中除H+、0H-之外所含离子是Fe2+、Na+、NO3-、SO42- | |
| C. | 若向该溶液中加入过量的稀硫酸,溶液中的阴离子会减少一种 | |
| D. | 若向该溶液中加入足量NaOH溶液,滤出沉淀,洗净灼烧后最多能得8.0g固体 |
| A. | NaN3与KN3结构类似,前者晶格能较小 | |
| B. | 第一电离能(I1):N>P>S | |
| C. | 钠晶胞结构属于体心结构,该晶胞分摊含2个钠原子 | |
| D. | 氮气常温下很稳定,是因为氮的电负性小 |
(1)该反应△S<0;升高温度,平衡常数减小(选填“增大”、“减小”或“不变”).
(2)T2温度下,2L容积固定的甲、乙两密闭容器中发生上述反应,测得平衡时有关数据如
表所列:
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 2molSO2、1molO2 | 4molSO3 |
| 平衡时n(SO3)/mol | 1 | m |
| 反应物的转化率 | α1 | α2 |
| A. | K+、Ba2+、Cl-、NO3- | B. | Ca2+、Al3+、HCO3-、Cl- | ||
| C. | Na+、AlO2-、OH-、SO42- | D. | K+、NH4+、NO3-、Fe2+ |
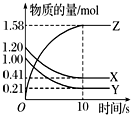 一定温度下,在2L的恒容密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:
一定温度下,在2L的恒容密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示: ;
;
 .
. 、
、 .
. (1)用A装置制SO2,化学反应方程式为Na2SO3+H2SO4(浓)=Na2SO4+H2O+SO2↑.
(1)用A装置制SO2,化学反应方程式为Na2SO3+H2SO4(浓)=Na2SO4+H2O+SO2↑.