题目内容
2.某有机化合物的结构简式为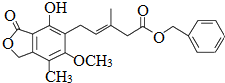 ,下列关于该化合物的说法不正确的是( )
,下列关于该化合物的说法不正确的是( )| A. | 该有机物的分子式为C23H24O6 | |
| B. | 1mol该化合物最多可以与9molH2发生加成反应 | |
| C. | 既可以使溴的四氯化碳溶液褪色,又可以使酸性KMnO4溶液褪色 | |
| D. | 既可以与FeCl3溶液发生显色反应,又可以与Na2CO3溶液反应 |
分析 由结构可知分子式,分子中含酚-OH、-COOC-、碳碳双键及醚键,结合酚、酯、烯烃的性质来解答.
解答 解:A.由结构可知,该有机物的分子式为C23H24O6,故A正确;
B.2个苯环及碳碳双键与氢气发生加成反应,则1mol该化合物最多可以与7molH2发生加成反应,故B错误;
C.含碳碳双键,既可以使溴的四氯化碳溶液褪色,又可以使酸性KMnO4溶液褪色,故C正确;
D.含酚-OH,既可以与FeCl3溶液发生显色反应,又可以与Na2CO3溶液反应,故D正确;
故选B.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,注意酚、烯烃的性质及应用,题目难度不大.

练习册系列答案
 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案 培优三好生系列答案
培优三好生系列答案
相关题目
6.在同温同压下,10mL气体A2和30mL气体B2完全反应可生成20mL气体C,则C的化学式为( )
| A. | A2B6 | B. | A2B3 | C. | A3B | D. | AB3 |
7.由Al3+→Al(OH)3→AlO${\;}_{2}^{-}$→___→Al3+系列变化中,___中应填写的是( )
| A. | Al(OH)3 | B. | AlCl3 | C. | HCl | D. | NaOH |
17.与化学平衡类似,电离平衡的平衡常数,叫做电离常数(用K表示).下表是某温度下几种常见弱酸的电离平衡常数:
回答下列问题:
(1)若把CH3COOH、HClO、H2CO3、HCO3-、H3PO4、H2PO4-、HPO42-都看作是酸,则它们酸性最强的是H3PO4(填化学式,下同),最弱的是HPO42-.
(2)向NaClO溶液中通入少量的二氧化碳,发生的离子方程式为CO2+ClO-+H2O═HClO+HCO3-,1.2mol•L-1的NaClO溶液pH=10.8(已知:lg2=0.3).
(3)求出该温度下,0.10mol•L-1的CH3COOH溶液中的c(H+)=1.4×10-3mol•L-1.
| 酸 | 电离方程式 | 电离平衡常数K |
| CH3COOH | CH3COOH?CH3COO-+H+ | 1.76×10-5 |
| HClO | CHl0?ClO-+H+ | 3.0×10-8 |
| H2CO3 | H2CO3?H++HCO3- HCO3-?H++CO32- | K1=4.4×10-7 K2=5.61×10-11 |
| H3PO4 | H3PO4?H++H2PO4- H2PO4-?H++HPO42- HPO42-?H++HPO43- | K1=7.1×10-3 K2=6.3×10-8 K3=4.2×10-13 |
(1)若把CH3COOH、HClO、H2CO3、HCO3-、H3PO4、H2PO4-、HPO42-都看作是酸,则它们酸性最强的是H3PO4(填化学式,下同),最弱的是HPO42-.
(2)向NaClO溶液中通入少量的二氧化碳,发生的离子方程式为CO2+ClO-+H2O═HClO+HCO3-,1.2mol•L-1的NaClO溶液pH=10.8(已知:lg2=0.3).
(3)求出该温度下,0.10mol•L-1的CH3COOH溶液中的c(H+)=1.4×10-3mol•L-1.
14.如图实验装置、试剂选用或操作正确的是( )
| A. |  用水吸收氨气 | B. |  除去CO2中含有的少量HCl | ||
| C. |  稀释浓硫酸 | D. |  海带灼烧成灰 |
11.下列正确的是( )
| A. | 1molH2燃烧放出的热量为H2的燃烧热 | |
| B. |  和 和 互为同系物 互为同系物 | |
| C. | Na2SO3和H2O2的反应为氧化还原反应 | |
| D. | BaSO4的水溶液不导电,故BaSO4是弱电解质 |
12.设NA为阿伏加德罗常数,下列说法错误的是( )
| A. | 1 mol H2O所含电子数为10NA | |
| B. | 1 mol Al与足量的稀盐酸溶液反应生成氢气1.5 mol | |
| C. | 在标准状况下,0.5NA Cl2所占的体积约是11.2 L | |
| D. | 在非标准状况下,22.4 L O2含有的分子数一定不是NA |
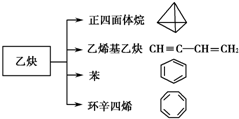 乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物.
乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物. .
. 、
、 .
.