题目内容
决定物质性质的重要因素是物质结构。请回答下列问题。
(1)紫外光的光子所具有的能量约为399 kJ·mol-1。根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因: 。
组成蛋白质的最简单的氨基酸中的碳原子杂化类型是 。
共价键 | C—C | C—N | C—S |
键能/(kJ·mol-1) | 347 | 305 | 259 |
(2)C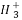 、—CH3(甲基)、C
、—CH3(甲基)、C 都是重要的有机反应中间体,有关它们的说法中正确的是( )
都是重要的有机反应中间体,有关它们的说法中正确的是( )
A.它们均由甲烷去掉一个氢原子所得
B.它们互为等电子体,碳原子均采取sp2杂化
C.C 与NH3、H3O+互为等电子体,几何构型均为三角锥形
与NH3、H3O+互为等电子体,几何构型均为三角锥形
D.C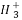 中的碳原子采取sp2杂化,所有原子均共面
中的碳原子采取sp2杂化,所有原子均共面
E.两个—CH3(甲基)或一个C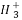 和一个C
和一个C 结合均可得到CH3CH3
结合均可得到CH3CH3
(3)金属阳离子含未成对电子越多,则磁性越强,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是 。
(4)某配合物的分子结构如下图所示,其分子内不含有 (填序号)。
A.离子键 B.极性键 C.金属键 D.配位键 E.氢键 F.非极性键

(1)紫外光具有的能量比蛋白质分子中主要化学键C—C、C—N和C—S的键能都大,紫外光的能量足以使这些化学键断裂,从而破坏蛋白质分子 sp2和sp3
(2)CDE
(3)CrO2 (4)AC
【解析】(2)—CH3(甲基)是甲烷去掉一个氢原子,而C 、C
、C 是在—CH3基础上失去、得到一个电子形成的,其电子数分别为8、10,A、B选项均错;C
是在—CH3基础上失去、得到一个电子形成的,其电子数分别为8、10,A、B选项均错;C 中的孤电子对数=
中的孤电子对数= =1,所以C
=1,所以C 、NH3、H3O+中的孤电子对数均为1,均形成3个σ键,均采用sp3杂化,C选项正确;C
、NH3、H3O+中的孤电子对数均为1,均形成3个σ键,均采用sp3杂化,C选项正确;C 中的孤电子对数=
中的孤电子对数= =0,D选项正确;(3)V5+、Cr4+的核外电子排布式为1s22s22p63s23p6、[Ar]3d2;(4)不属于离子化合物,更不属于金属晶体
=0,D选项正确;(3)V5+、Cr4+的核外电子排布式为1s22s22p63s23p6、[Ar]3d2;(4)不属于离子化合物,更不属于金属晶体

氯碱工业的产物NaOH与不同物质反应可以生成不同的盐。已知常温下,浓度均为0.1 mol·L-1的4种钠盐溶液的pH如下表:
溶质 | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
pH | 11.6 | 9.7 | 10.3 | 5.2 |
下列说法中正确的是( )
A.向氯水中加入NaHCO3溶液,可以增大氯水中次氯酸的浓度
B.四种溶液中,水的电离程度最大的是NaClO
C.常温下,相同物质的量浓度的H2SO3、H2CO3、HClO溶液,pH最大的是H2SO3溶液
D.NaHSO3溶液中离子浓度大小顺序为c(Na+)>c(H+)>c(HS )>c(S
)>c(S )>c(OH-)
)>c(OH-)




