题目内容
13.在含有大量Ba2+、H+、NO${\;}_{3}^{-}$的溶液中,还可能大量共存的离子是( )| A. | SO${\;}_{4}^{2-}$ | B. | NH${\;}_{4}^{+}$ | C. | HCO${\;}_{3}^{-}$ | D. | OH- |
分析 根据离子之间不能结合生成水、气体、程度、弱电解质等,则离子大量共存,以此来解答.
解答 解:A.SO42-、Ba2+结合生成沉淀,不能大量共存,故A错误;
B.铵根离子不与Ba2+、OH-、NO3-离子发生反应,能大量共存,故B正确;
C.碳酸氢根与氢离子不能大量共存,故C错误;
D.H+与OH-结合生成水,不能大量共存,故D错误,
故选B.
点评 本题考查离子的共存,为高频考点,把握常见离子的反应为解答的关键,侧重复分解反应的离子共存考查,题目难度不大.

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案
相关题目
19.下列卤代烃发生消去反应后只生成一种烯烃的是( )
| A. | CH3Cl | B. | (CH3)3CBr | C. | (CH3)3CCH2Cl | D. | (CH3)2CBrCH(CH3)2 |
4.X、Y、Z、W是原子序数依次增大的四种短周期主族元素,其中X、Y同主族,Y、Z、W同周期,X-与氦原子电子层结构相同,Z原子最外层电子数是内层电子总数的一半,W的最高正价与最低负价的代数和为4,下列说法正确的是( )
| A. | X和Y能形成共价化合物 | |
| B. | Y与W形成的化合物Y2W2中含有离子键和共价键 | |
| C. | 简单离子的半径:Y>Z>W>X | |
| D. | 最高价氧化物对应水化物的酸性:Z>W |
1.如图是可逆反应X2+3Y2?2Z在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )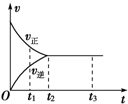

| A. | t1时,只有正方向反应 | B. | 0~t1,c(Z)在减小 | ||
| C. | t2~t3,反应不再进行 | D. | t2~t3,各物质的浓度不再发生变化 |
8.太空探索器常用${\;}_{94}^{238}$Pu制成的核电池提供动力,该钚原子的中子数为( )
| A. | 332 | B. | 238 | C. | 144 | D. | 94 |
18.工业上生产氮化硅陶瓷的反应为:3SiCl4+2N2+6H2 $\frac{\underline{\;高温\;}}{\;}$Si3N4+12HCl,有关该反应的说法正确的是( )
| A. | SiCl4是氧化剂 | B. | N2是还原剂 | C. | H2被还原 | D. | N2发生还原反应 |
5.短周期主族元素X、Y、Z、W的原子序数依次增大,四种元素的原子K层电子数总和为7,L层电子数总和为22,M层电子数总和为12.下列说法正确的是( )
| A. | 最高正价由低到高的顺序为:X、Z、Y、W | |
| B. | 原子半径由小到大的顺序为:X、Y、Z、W | |
| C. | 最外层电子数由少到多的顺序为:X、Z、Y、W | |
| D. | 简单氢化物的稳定性由弱到强的顺序为:Y、Z、W |
2.根据下表信息回答以下问题:
部分短周期元素的原子半径及主要化合价
(1)将A、D、E、F、H对应的简单离子按照半径由小到大的顺序填空Mg2+<Na+<O2-<Cl-<S2-.
(2)B、H两元素的最高价氧化物所对应的水化物相互反应的离子方程式是Al(OH)3+3H+=Al3++3H2O.
(3)实验室中制取H单质反应的化学方程式是MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
| 元素 | A | B | C | D | E | F | G | H |
| 原子半径(nm) | 0.130 | 0.118 | 0.090 | 0.102 | 0.073 | 0.154 | 0.037 | 0.099 |
| 主要化合价 | +2 | +3 | +2 | +6,-2 | -2 | +1 | +1 | +7,-1 |
(1)将A、D、E、F、H对应的简单离子按照半径由小到大的顺序填空Mg2+<Na+<O2-<Cl-<S2-.
(2)B、H两元素的最高价氧化物所对应的水化物相互反应的离子方程式是Al(OH)3+3H+=Al3++3H2O.
(3)实验室中制取H单质反应的化学方程式是MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
 )常用于肉香和海鲜香精配方中.
)常用于肉香和海鲜香精配方中. .
.