题目内容
(1)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2,Q基态原子的外围电子(价电子)排布式为 ,T2+的未成对电子数是 ;
(2)中国古代四大发明之一黑火药,它的爆炸反应为S+2KNO3+3C
A+N2↑+3CO2↑(其中A的化学式未知)
①除S外,上列元素的电负性从大到小依次为 .
②在生成物中,A的晶体类型为 ; ,CO2中心原子轨道的杂化类型是 .
③已知CN-与N2结构相似,推算HCN分子中σ键与π键数目之比为 .
(3)元素金(Au)处于周期表中的第六周期,与Cu同族,一种铜金合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为 ;该晶体中,原子之间的作用力是 ;上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中.若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2结构相似,该晶体储氢后的化学式应为 .
(2)中国古代四大发明之一黑火药,它的爆炸反应为S+2KNO3+3C
| ||
①除S外,上列元素的电负性从大到小依次为
②在生成物中,A的晶体类型为
③已知CN-与N2结构相似,推算HCN分子中σ键与π键数目之比为
(3)元素金(Au)处于周期表中的第六周期,与Cu同族,一种铜金合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为
考点:原子核外电子排布,元素电离能、电负性的含义及应用,晶胞的计算,原子轨道杂化方式及杂化类型判断
专题:原子组成与结构专题,化学键与晶体结构
分析:(1)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,则Q、T处于第Ⅷ族,且原子序数T比Q多2,则Q为Fe元素,T为Ni元素,再经过核外电子排布规律解答;
(2)①同周期自左而右电负性增大,金属性越强电负性越小,据此解答;
②由原子守恒可知,物质A为K2S,属于离子化合物;含极性共价键的分子为CO2,分子中C原子形成2个C=O键,不含孤对电子,杂化轨道数目为2;
③CN-与N2结构相似,C原子与N原子之间形成三键,则HCN分子结构式为H-C≡N,三键中含有1个σ键、2个π键,单键属于σ键;
(3)元素金(Au)处于周期表中的第六周期,与Cu同族,则最外层电子数为1,以此判断电子排布式,利用均摊法计算晶胞;CaF2的结构如图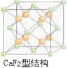 ,利用均摊法计算.
,利用均摊法计算.
(2)①同周期自左而右电负性增大,金属性越强电负性越小,据此解答;
②由原子守恒可知,物质A为K2S,属于离子化合物;含极性共价键的分子为CO2,分子中C原子形成2个C=O键,不含孤对电子,杂化轨道数目为2;
③CN-与N2结构相似,C原子与N原子之间形成三键,则HCN分子结构式为H-C≡N,三键中含有1个σ键、2个π键,单键属于σ键;
(3)元素金(Au)处于周期表中的第六周期,与Cu同族,则最外层电子数为1,以此判断电子排布式,利用均摊法计算晶胞;CaF2的结构如图
 ,利用均摊法计算.
,利用均摊法计算.解答:
解:(1)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,则Q、T处于第Ⅷ族,且原子序数T比Q多2,则Q为Fe元素,T为Ni元素,Fe元素是26号元素,Fe原子价电子排布式为3d64s2,Ni2+的核外电子排布式为1s22s22p63s23d8,3d能级有2个单电子,
故答案为:3d64s2;2;
(2)①同周期自左而右电负性增大,金属性越强电负性越小,故电负性O>N>C>K,
故答案为:O>N>C>K;
②由原子守恒可知,物质A为K2S,属于离子化合物,属于离子晶体,
含极性共价键的分子为CO2,分子中C原子形成2个C=O键,不含孤对电子,杂化轨道数目为2,为sp杂化方式,
故答案为:离子晶体;sp;
③CN-与N2结构相似,C原子与N原子之间形成三键,则HCN分子结构式为H-C≡N,三键中含有1个σ键、2个π键,单键属于σ键,故HCN分子中σ键与π键数目之比为1:1,
故答案为:1:1;
(3)元素金(Au)处于周期表中的第六周期,与Cu同族,则最外层电子数为1,则价电子排布式为5d106s1,在晶胞中Cu原子处于面心,N(Cu)=6×
=3,Au原子处于顶点位置,N(Au)=8×
=1,则该合金中Cu原子与Au原子数量之比为3:1,为金属晶体,原子间的作用力为金属键键合力;CaF2的结构如图 ,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中,则H原子应位于晶胞内部,则应含有8个H,则化学式为Cu3AuH8;
,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中,则H原子应位于晶胞内部,则应含有8个H,则化学式为Cu3AuH8;
故答案为:5d106s1;3:1;金属键;Cu3AuH8.
故答案为:3d64s2;2;
(2)①同周期自左而右电负性增大,金属性越强电负性越小,故电负性O>N>C>K,
故答案为:O>N>C>K;
②由原子守恒可知,物质A为K2S,属于离子化合物,属于离子晶体,
含极性共价键的分子为CO2,分子中C原子形成2个C=O键,不含孤对电子,杂化轨道数目为2,为sp杂化方式,
故答案为:离子晶体;sp;
③CN-与N2结构相似,C原子与N原子之间形成三键,则HCN分子结构式为H-C≡N,三键中含有1个σ键、2个π键,单键属于σ键,故HCN分子中σ键与π键数目之比为1:1,
故答案为:1:1;
(3)元素金(Au)处于周期表中的第六周期,与Cu同族,则最外层电子数为1,则价电子排布式为5d106s1,在晶胞中Cu原子处于面心,N(Cu)=6×
| 1 |
| 2 |
| 1 |
| 8 |
 ,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中,则H原子应位于晶胞内部,则应含有8个H,则化学式为Cu3AuH8;
,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中,则H原子应位于晶胞内部,则应含有8个H,则化学式为Cu3AuH8;故答案为:5d106s1;3:1;金属键;Cu3AuH8.
点评:本题考查电负性、电子排布式、杂化轨道、等电子体、晶胞的计算等,难度中等,注意对基础知识的理解掌握,注意(1)中元素推断,整体把握元素周期表.

练习册系列答案
相关题目
下列反应类型:①酯化、②取代、③消去、④加成、⑤水解、⑥还原,可能在有机物分子中引入羟基的是( )
| A、①②③⑥ | B、②④⑤ |
| C、②④⑤⑥ | D、②④⑥ |
下列说法正确的是( )
| A、纸层析法分离铁离子和铜离子的实验中,应沿试管壁小心地将展开剂慢慢倒入试管底部 |
| B、硫酸铜溶液中加入过量浓氨水,最终溶液中出现大量淡蓝色絮状沉淀 |
| C、在氯化铝溶液中分别加入过量的氢氧化钠溶液和浓氨水,均可形成铝的配合物Al(OH)4- |
| D、在盛有氯化钴溶液的试管中,加入一定量的浓盐酸,溶液的颜色由粉红色变为蓝色 |
化学与能源开发、环境保护、资源利用等密切相关.下列有关说法不正确的是( )
| A、将开采出的煤通过干馏、气化、液化等多种途径实现其综合利用 |
| B、氢气是清洁能源,工业上可用电解水法来开发氢能源 |
| C、向污水中投放明矾,利用生成的胶体净水:Al3++3H2O?Al(OH3)(胶体)+3H+ |
| D、“光化学烟雾”、“硝酸型酸雨”的形成都与氮氧化合物有关 |
下列说法不正确的是( )
| A、制摩尔盐时用酒精洗涤产品,制阿司匹林时用冷水洗涤产品 |
| B、培养明矾晶体时,为得到较大颗粒的晶体,应自然冷却,并静置过夜 |
| C、做“食醋总酸含量的测定”实验时,必须先将市售食醋稀释10倍,然后用洗净的酸式滴定管量取一定体积的稀释液于洁净的锥形瓶中,锥形瓶不需要先用醋酸溶液润洗 |
| D、铁钉镀锌前,先要用砂纸打磨直至表面变得光滑,然后放入氢氧化钠溶液中浸泡5分钟,用水洗净后还需放入稀盐酸中浸泡,再用水洗净 |
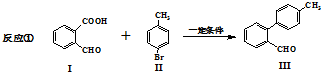
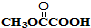 与
与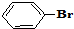 也可以发生类似反应①的反应,有机产物的结构简式为
也可以发生类似反应①的反应,有机产物的结构简式为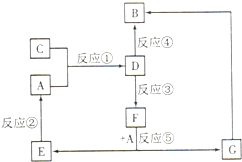 A、B、C、D、E、F、G七种物质间存在如图所示的转化关系,其中A、B、D、G含有同种元素.已知:
A、B、C、D、E、F、G七种物质间存在如图所示的转化关系,其中A、B、D、G含有同种元素.已知: