题目内容
2.下列四个图中,白球代表氢原子,黑球代表氦原子,表示等质量的氢气与氦气混合的是( )| A. |  | B. |  | C. |  | D. |  |
分析 如图表示氦分子与氢气分子的数量关系,分子数之比等于该物质的物质的量之比,根据n=$\frac{m}{M}$判断等质量的氢气与氦气的物质的量之比,注意稀有气体是单原子分子.
解答 解:氦气的摩尔质量为4g/mol.氢气的摩尔质量为2g/mol,
设质量为4g,则氦气的物质的量为:$\frac{4g}{4g/mol}$=1mol,
氢气的物质的量为:$\frac{4g}{2g/mol}$=2mol,
所以氢气分子与氦气分子的分子数之比为:2mol:1mol=2:1,
稀有气体为单原子分子,故A、C错误;
B中氢气与氦气的物质的量之比为2:1,D中为1:1,故B正确、D错误;
故选B.
点评 本题考查学生对信息的提取以及阿伏伽德罗定律的利用,题目难度不大,明确气体为单原子为分子为解答关键,注意掌握阿伏伽德罗定律及其推论的内容.

练习册系列答案
相关题目
13.某溶液可能含有NH4+、K+、Ba2+、Fe3+、I-、SO32-、SO42-中的几种,现取100mL溶液先加入足量氯水,溶液呈无色,然后滴加足量BaCl2溶液,得到沉淀4.66g,在滤液中加足量NaOH溶液并加热,生成的气体在标准状况下体积为1.12L.
已知:SO32-+Cl2+H2O═SO42-+2Cl-+2H+;2Fe3++2I-═2Fe2++I2
根据上述实验,以下推测正确的是( )
已知:SO32-+Cl2+H2O═SO42-+2Cl-+2H+;2Fe3++2I-═2Fe2++I2
根据上述实验,以下推测正确的是( )
| A. | 原溶液一定存在NH4+、I- | |
| B. | 原溶液一定不含Ba2+、Fe3+、I- | |
| C. | 原溶液可能存在K+、Fe3+、SO42- | |
| D. | 另取试液滴加足量盐酸、BaCl2溶液,即可确定溶液所有的离子组成 |
6.能正确表示下列反应的离子方程式是( )
| A. | 用醋酸除去水垢:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 足量硫酸铝与纯碱反应:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑ | |
| C. | 氯气与水反应:Cl2+H2O=2H++Cl-+ClO- | |
| D. | 向Ba(OH)2溶液中加入少量NaHSO3溶液:2HSO3-+Ba2++2OH-═BaSO3↓+SO32-+2H2O |
 ,C和E形成化合物的电子式
,C和E形成化合物的电子式 .
.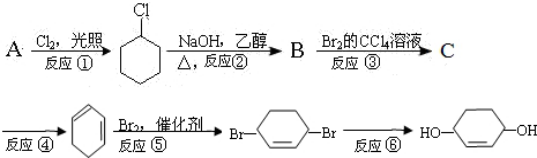
 .
.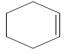 +Br2→
+Br2→ .
.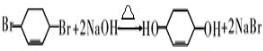 .
.
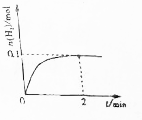 一定温度下,向2L密闭容器中加入1molNH3(g).发生反应2NH3(g)?3H2(g)+N2(g)△H=+92kJ/mol
一定温度下,向2L密闭容器中加入1molNH3(g).发生反应2NH3(g)?3H2(g)+N2(g)△H=+92kJ/mol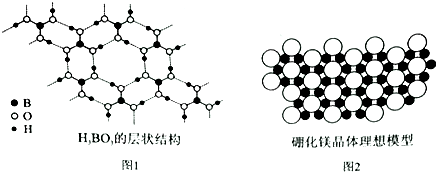 硼元素在化学中有很重要的地位,硼及其化合物广泛应用于永磁材料、超导材料、复合材料等高新材料领域.
硼元素在化学中有很重要的地位,硼及其化合物广泛应用于永磁材料、超导材料、复合材料等高新材料领域.