题目内容
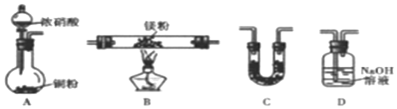
6.下列各组仪器常用于物质分离的是( )
| A. | ①③⑤ | B. | ②⑤ | C. | ②③⑤ | D. | ②③④ |
分析 根据实验室用于物质的分离操作分析,常见分离操作有洗气、过滤、蒸发、蒸馏、分液等,据此进行解答.
解答 解:①为量气装置,不能用于分离,故①错误;
②为普通漏斗,可用于过滤分离,故②正确;
③为分液漏斗,可用于萃取、分液操作,故③正确;
④为研钵,用来研磨固体药品,故④错误;
⑤为蒸馏烧瓶,可用来蒸馏分离沸点不同的液体,故⑤正确;
则能用来分离的有②③⑤,
故选C.
点评 本题考查常见仪器的使用方法,题目难度不大,明确常见仪器的构造及使用方法为解答关键,试题侧重基础知识的考查,有利于提高学生的化学实验能力.

练习册系列答案
 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案
相关题目
18.下列说法正确的是( )
| A. | 漂白粉、福尔马林、冰水、王水、氯水均为混合物 | |
| B. | 手机外壳上铁的碳纤维外模是一种新型的无机非金属材料 | |
| C. | Si常用做信息高速公路的骨架--光导纤维的主要材料 | |
| D. | 浊液、胶体,溶液三种分散系的本质区别是能否产生丁达尔效应 |
17.下列叙述正确的是( )
①一束平行光线照射蛋白质溶液时,从侧面可看到光亮的通路
②一定温度和压强下,气体体积主要由其分子的物质的量决定
③气体摩尔体积是指单位物质的量的气体所占的体积,其单位是L
④同温同压下,气体的密度与气体的相对分子质量成正比
⑤在同温同体积时,气体的物质的量越大,则压强越大
⑥蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热
⑦标准状况下,将lg铝片投入20mL 18mol/L的硫酸中,铝片完全溶解.
①一束平行光线照射蛋白质溶液时,从侧面可看到光亮的通路
②一定温度和压强下,气体体积主要由其分子的物质的量决定
③气体摩尔体积是指单位物质的量的气体所占的体积,其单位是L
④同温同压下,气体的密度与气体的相对分子质量成正比
⑤在同温同体积时,气体的物质的量越大,则压强越大
⑥蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热
⑦标准状况下,将lg铝片投入20mL 18mol/L的硫酸中,铝片完全溶解.
| A. | ①⑤⑥⑦ | B. | ①②④⑤ | C. | ①②⑥⑦ | D. | ②③④⑤ |
14.碱式碳酸铜Cu2(OH)2CO3又称为铜绿,属于( )
| A. | 酸 | B. | 碱 | C. | 盐 | D. | 氧化物 |
1.25℃时,将浓度均为 0.1mol•L-1、体积分别为 Va 和 Vb 的 HA 溶液与 BOH 溶液按不同体积比混合,保持 Va+Vb=100mL,Va、Vb 与混合液的 pH 的关系如图所示.下列说法正确的是( )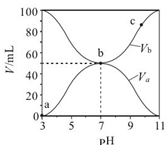

| A. | Ka(HA)=10-6 mol•L-1 | |
| B. | b 点时,c(B+)=c(A-)=c(H+)=c(OH-) | |
| C. | c 点时,$\frac{c({A}^{-})}{c(O{H}^{-})•c(HA)}$随温度升高而减小 | |
| D. | a→c 过程中水的电离程度始终增大 |
11.已知R元素的某种同位素能形成化合物AmRn,其中A的化合价为+n.该化合物中一个R微粒的核外电子数为a,核内中子数为b,则该同位素的原子符号是( )
| A. | ${\;}_{a+m}^{b+m+n}R$ | B. | ${\;}_{a+m}^{b+a-m}R$ | C. | ${\;}_{a}^{b+a}R$ | D. | ${\;}_{a-m}^{a-m+b}R$ |
18.亚硝酸钠是一种工业盐,外观与食盐非常相似,毒性较强.
(I)经查:①Ksp(AgNO2)=2.0×10-8,Ksp(AgCl)=1.8×10-10;③Ka(HNO2)=5.1×10-4.请设计最简单的方法鉴别NaNO2和NaCl两种固体分别取两种固体样品少量于试管中加水溶解,再分别滴加酚酞试液,变红色的为NaNO2.
(Ⅱ)某化学实验小组用如图装置(略去夹持仪器)制备亚硝酸钠,并测定其产品的质量分数.
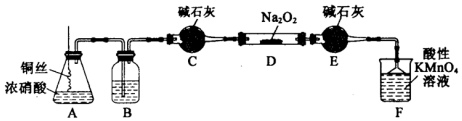
已知:①2NO+Na2O2═2NaNO2;
②酸性条件下,NO和NO2均能与MnO4-反应生成NO3-和Mn2+.
(1)这样使用铜丝的优点是可以控制反应的发生与停止.
(2)装置A中发生反应的化学方程式为Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;装置B中盛放的药品是C(填序号).
①浓硫酸②NaOH溶液③水④四氯化碳
(3)该小组取5.000g制取的样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.100mol•L-1酸性KMnO4溶液进行滴定,实验所得数据如表:
①第一次实验数据出现异常,造成这种异常的原因可能是bc(填代号).
a.锥形瓶洗净后未干燥
b.酸式滴定管用蒸馏水洗净后未用标准液润洗
c.滴定终点时仰视读数
②酸性KMnO4溶液滴定亚硝酸钠溶液的离子方程式为2MnO4-+5NO2-+6H+=2Mn2++5NO3-+3H2O.
③该样品中亚硝酸钠的质量分数为69.0%.
(I)经查:①Ksp(AgNO2)=2.0×10-8,Ksp(AgCl)=1.8×10-10;③Ka(HNO2)=5.1×10-4.请设计最简单的方法鉴别NaNO2和NaCl两种固体分别取两种固体样品少量于试管中加水溶解,再分别滴加酚酞试液,变红色的为NaNO2.
(Ⅱ)某化学实验小组用如图装置(略去夹持仪器)制备亚硝酸钠,并测定其产品的质量分数.

已知:①2NO+Na2O2═2NaNO2;
②酸性条件下,NO和NO2均能与MnO4-反应生成NO3-和Mn2+.
(1)这样使用铜丝的优点是可以控制反应的发生与停止.
(2)装置A中发生反应的化学方程式为Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;装置B中盛放的药品是C(填序号).
①浓硫酸②NaOH溶液③水④四氯化碳
(3)该小组取5.000g制取的样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.100mol•L-1酸性KMnO4溶液进行滴定,实验所得数据如表:
| 滴定次数 | 1 | 2 | 3 | 4 |
| 消耗KMn04溶液体积/mL | 20.90 | 20.12 | 20.00 | 19.88 |
a.锥形瓶洗净后未干燥
b.酸式滴定管用蒸馏水洗净后未用标准液润洗
c.滴定终点时仰视读数
②酸性KMnO4溶液滴定亚硝酸钠溶液的离子方程式为2MnO4-+5NO2-+6H+=2Mn2++5NO3-+3H2O.
③该样品中亚硝酸钠的质量分数为69.0%.
16.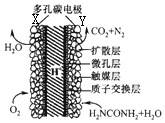 直接尿素电池的结构如图所示,下列说法不正确的是( )
直接尿素电池的结构如图所示,下列说法不正确的是( )
 直接尿素电池的结构如图所示,下列说法不正确的是( )
直接尿素电池的结构如图所示,下列说法不正确的是( )| A. | 电池工作时,化学能转化为电能 | |
| B. | 电池工作时,H+向Y极区迁移,Y极周围溶液的pH减小 | |
| C. | 碳电池采用多孔并用触媒层可加快反应速率 | |
| D. | Y极的电极反应式为H2NCONH2+H2O-6e-═N2↑+CO2+6H+ |