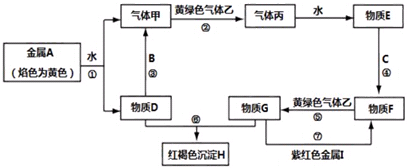
题目内容
15.由两种可溶性正盐组成的固体混合物,按下列步骤做实验(设下列各反应中的反应物恰好完全反应).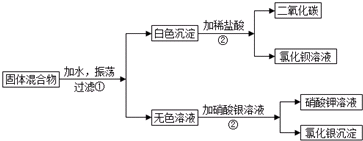
(1)由此推断该混合物由K2CO3、BaCl2组成.
(2)写出各步反应的离子方程式:
①CO32-+Ba2+=BaCO3↓
②BaCO3+2H+=Ba2++CO2↑+H2O
③Ag++Cl-=AgCl↓.
分析 混合物加入水过滤,得到白色沉淀,白色沉淀加入盐酸生成二氧化碳和氯化钡,可知白色沉淀为BaCO3,无色溶液加入硝酸银溶液生成硝酸钾和氯化银,可知无色溶液含有KCl,可知混合物有K2CO3和BaCl2组成,以此解答该题.
解答 解:混合物加入水过滤,得到白色沉淀,白色沉淀加入盐酸生成二氧化碳和氯化钡,可知白色沉淀为BaCO3,无色溶液加入硝酸银溶液生成硝酸钾和氯化银,可知无色溶液含有KCl,可知混合物有K2CO3和BaCl2组成,
(1)有以上分析可知混合物由K2CO3和BaCl2组成,故答案为:K2CO3;BaCl2;
(2)K2CO3和BaCl2在溶液中发生CO32-+Ba2+=BaCO3↓;BaCO3加入盐酸发生反应生成二氧化碳和氯化钡,反应的离子方程式为BaCO3+2H+=Ba2++CO2↑+H2O,KCl与硝酸银溶液生成硝酸钾和氯化银,反应的离子方程式为Ag++Cl-=AgCl↓,
故答案为:CO32-+Ba2+=BaCO3↓;BaCO3+2H+=Ba2++CO2↑+H2O;Ag++Cl-=AgCl↓.
点评 本题属于框图式的推断题,为高频考点和常见题型,侧重于学生的分析能力的考查,在解此类题时,首先将题中有特征的物质推出,然后结合推出的物质和题中的转化关系推导剩余的物质,最后将推出的各种物质代入转化关系中进行验证即可,难度不大.

练习册系列答案
相关题目
5.表为元素周期表的一部分,请参照元素①~⑩在表中的位置,用化学用语回答下列问题:
(1)⑦为O(填元素符号);
(2)①、③、⑤的最高价最高价氧化物对应的水化物中,碱性最强的是NaOH (填化学式);
(3)②、③、④三种元素可形成的离子,离子半径由大到小的顺序为K+>Ca2+>Mg2+(请填离子符号);
(4)①和⑨两元素形成化合物灼烧时的焰色为黄 色;该化合物的溶液与元素⑧的单质反应的离子方程式为Cl2+2Br-=2Cl-+Br2.
| 族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑥ | ⑦ | ||||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
(2)①、③、⑤的最高价最高价氧化物对应的水化物中,碱性最强的是NaOH (填化学式);
(3)②、③、④三种元素可形成的离子,离子半径由大到小的顺序为K+>Ca2+>Mg2+(请填离子符号);
(4)①和⑨两元素形成化合物灼烧时的焰色为黄 色;该化合物的溶液与元素⑧的单质反应的离子方程式为Cl2+2Br-=2Cl-+Br2.
6.下列说法不正确的是( )
| A. | 将少量氯化钴晶体溶于一定浓度的盐酸溶液呈紫色,加热后溶液颜色变成蓝色 | |
| B. | 中和热测定实验中,环形玻璃搅拌棒不能用铜质搅拌棒代替 | |
| C. | 容量瓶、分液漏斗、滴定管使用时都必须检查是否漏水 | |
| D. | 滴定管水洗后必须烘干才能使用 |
10.下列微粒中:
①13Al3+ ②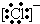 ③
③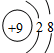 ④F- 其中核外电子数相同的是( )
④F- 其中核外电子数相同的是( )
①13Al3+ ②
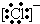 ③
③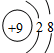 ④F- 其中核外电子数相同的是( )
④F- 其中核外电子数相同的是( )| A. | ①③ | B. | ②③④ | C. | ②④ | D. | ①③④ |
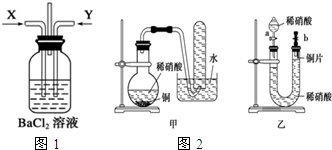 请分析回答某同学在探究浓硫酸、稀硫酸、浓硝酸、稀硝酸分别与铜反应的实验中发生的有关问题.
请分析回答某同学在探究浓硫酸、稀硫酸、浓硝酸、稀硝酸分别与铜反应的实验中发生的有关问题.
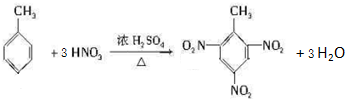 .
.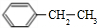 、
、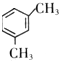 .
.