题目内容
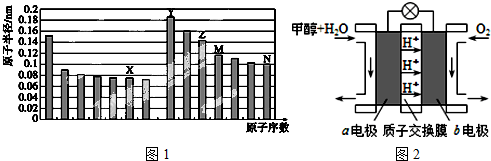
(1)如图1是部分短周期元素原子半径与原子序数的关系图.
①由X、Y形成的既含离子键又含共价键的物质的电子式:
②实验室制备N单质的离子反应方程式:
(2)CaCO3是一种难溶物质,其Ksp=2.8×10-9.现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2.8×10-5mol/L,则生成沉淀所需CaCl2溶液的最小浓度为 .
(3)羟胺(NH2OH) 可看成是氨分子内的l 个氢原子被羟基取代的产物,常用作还原剂,其水溶液显弱碱性.NH2OH 的水溶液呈弱碱性的原理与NH3的水溶液相似,用电离方程式表示NH2OH 在水溶液中显碱性的原因 .
(4)“甲醇-空气”绿色燃料电池的工作原理示意图如图2,写出以石墨为电极的电池工作时负极的电极反
应式 ,利用该电池电解1L 0.5mol/L的CuSO4溶液,当消耗560mLO2(标准状况下)时,电解后溶液的pH= (溶液电解前后体积的变化忽略不计).

①由X、Y形成的既含离子键又含共价键的物质的电子式:
②实验室制备N单质的离子反应方程式:
(2)CaCO3是一种难溶物质,其Ksp=2.8×10-9.现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2.8×10-5mol/L,则生成沉淀所需CaCl2溶液的最小浓度为
(3)羟胺(NH2OH) 可看成是氨分子内的l 个氢原子被羟基取代的产物,常用作还原剂,其水溶液显弱碱性.NH2OH 的水溶液呈弱碱性的原理与NH3的水溶液相似,用电离方程式表示NH2OH 在水溶液中显碱性的原因
(4)“甲醇-空气”绿色燃料电池的工作原理示意图如图2,写出以石墨为电极的电池工作时负极的电极反
应式
考点:难溶电解质的溶解平衡及沉淀转化的本质,原子结构与元素周期律的关系,原电池和电解池的工作原理,弱电解质在水溶液中的电离平衡
专题:
分析:(1)图中元素分别为第二周期和第三周期元素的原子半径的变化,根据原子序数关系可知X为O元素,Y为Na元素,Z为Al元素,M为Si元素,N为Cl元素,结合对应物质的性质解答该题;
(2)Na2CO3溶液的浓度为2.8×10-5mol/L,等体积混合后溶液中c(CO32-)=1.4×10-5mol/L,根据Ksp=c(CO32-)?c(Ca2+)计算沉淀时混合溶液中c(Ca2+),原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍;
(3)根据氨水呈弱碱性的原理分析羟胺呈弱碱性的原因;
(4)负极发生氧化反应,根据电子守恒求消耗的氢氧根离子浓度.
(2)Na2CO3溶液的浓度为2.8×10-5mol/L,等体积混合后溶液中c(CO32-)=1.4×10-5mol/L,根据Ksp=c(CO32-)?c(Ca2+)计算沉淀时混合溶液中c(Ca2+),原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍;
(3)根据氨水呈弱碱性的原理分析羟胺呈弱碱性的原因;
(4)负极发生氧化反应,根据电子守恒求消耗的氢氧根离子浓度.
解答:
解:(1)图中元素分别为第二周期和第三周期元素的原子半径的变化,根据原子序数关系可知X为O元素,Y为Na元素,Z为Al元素,M为Si元素,N为Cl元素,
①由O、Na形成的既含离子键又含共价键的物质是过氧化钠,过氧化钠是由2个钠离子与1个过氧根离子通过离子键结合而成的离子化合物,电子式为: ,故答案为:
,故答案为: ;
;
②实验室制备氯气单质是利用浓盐酸与二氧化锰,反应的离子反应方程式为MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O,故答案为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O;
(2)Na2CO3溶液的浓度为2.8×10-5mol/L,等体积混合后溶液中c(CO32-)=
×2.8×10-5mol/L=1.4×10-5mol/L,根据Ksp=c(CO32-)?c(Ca2+)=2.8×10-9可知,c(Ca2+)=
mol/L=2×10-4mol/L,原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍,故原溶液CaCl2溶液的最小浓度为2×2×10-4mol/L=4×10-4mol/L,故答案为:4×10-4mol/L;
(3)羟胺和水反应生成[NH3OH]+和OH-,导致溶液中氢氧根离子浓度大于氢离子浓度而使溶液呈碱性,故答案为:NH2OH+H2O?[NH3OH]++OH-;
(4)负极发生氧化反应,负极CH3OH-6e-+H2O=CO2+6H+,依据电子守4OH-~O2~4e-,当消耗560mLO2(标准状况下)时即
=0.025mol,依据电子守恒4OH-~O2~4e-,则消耗的氢氧根离子物质的量为0.025mol×4=0.1mol,所以溶液中氢离子的浓度为:
=0.1mol/L,故pH=1,故答案为:CH3OH-6e-+H2O=CO2+6H+;1.
①由O、Na形成的既含离子键又含共价键的物质是过氧化钠,过氧化钠是由2个钠离子与1个过氧根离子通过离子键结合而成的离子化合物,电子式为:
 ,故答案为:
,故答案为: ;
;②实验室制备氯气单质是利用浓盐酸与二氧化锰,反应的离子反应方程式为MnO2+4H++2Cl-
| ||
| ||
(2)Na2CO3溶液的浓度为2.8×10-5mol/L,等体积混合后溶液中c(CO32-)=
| 1 |
| 2 |
| 2.8×10-9 |
| 1.4×10-5 |
(3)羟胺和水反应生成[NH3OH]+和OH-,导致溶液中氢氧根离子浓度大于氢离子浓度而使溶液呈碱性,故答案为:NH2OH+H2O?[NH3OH]++OH-;
(4)负极发生氧化反应,负极CH3OH-6e-+H2O=CO2+6H+,依据电子守4OH-~O2~4e-,当消耗560mLO2(标准状况下)时即
| 0.56 |
| 22.4 |
| 0.1 |
| 1 |
点评:本题主要考查的是元素的推断、电子式的书写、溶度积常数的有关计算、原电池原理等,综合性较强,有一定难度.

练习册系列答案
相关题目
把100g某NaOH溶液,其密度是1.22g/cm3,加热蒸发浓缩后,留下溶液50mL时,其物质的量浓度是8mol/L,原溶液的浓度是( )
| A、160 g/L |
| B、3.28 mol/L |
| C、4.88 mol/L |
| D、16% |
常温下,下列各组离子在制定溶液中一定能大量共存的是( )
| A、无色透明的溶液:Na+、Al3+、Cl-、AlO2- |
| B、pH=1的溶液:Na+、NH4+、Cu2+、NO3- |
| C、与铝反应产生大量氢气的溶液:Na+、K+、Cl-、AlO2- |
| D、使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl- |
为提纯下列物质(括号内物质为杂质),所选用的试剂、除杂和分离方法均正确的是( )
| 物 质 | 除杂试剂 | 除杂和分离方法 | |
| A | 乙醇(水) | -- | 分液 |
| B | 铝粉(镁粉) | NaOH溶液 | 过滤 |
| C | CO2(CO) | O2 | 点燃 |
| D | CO(CO2) | NaOH溶液 | 洗气 |
| A、A | B、B | C、C | D、D |
常温下,下列各组离子在指定溶液中能大量共存的是( )
| A、pH=l的溶液中:Mg2+、Na+、AlO2-、SO42- |
| B、含有大量NO3-的溶液中:H+、Na+、Fe3+、SO42- |
| C、含有0.1mol?L-1 Fe3+的溶液中:K+、Mg2+、I-、NO3- |
| D、澄清透明的溶液:Cu2+、Mg2+、SO42-、Cl- |
