题目内容
20.A、B、C、D、E、F、G都是短周期元素,原子序数依次增大.A原子半径是短周期最小的,B、C处于同一周期,D、E、F同处另一周期.D、C可按原子个数比2:l和1:1分别形成两种离子化合物甲和乙.B原子的最外层电子数比次外层电子层多3个.F是地壳中含量最高的金属元素.C、G同主族.根据以上信息回答下列问题:(1)B元素在周期表中的位置是第二周期第VA族乙物质的电子式是
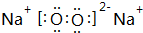
(2)B、C、D、E、F、G六种元素的原子半径由小到大的顺序是O<N<S<Al<Mg<Na (用元素符号填写)
(3)写出F的最高价氧化物对应的水化物和D的最高价氧化物对应的水化物反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O.
(4)F的单质、石墨和二氧化钛(TiO2)按比例混合,高温下反应得到的两种化合物均由两种元素组成,其中有一种产物是TiC其反应化学方程式为4Al+3C+3TiO2$\frac{\underline{\;高温\;}}{\;}$2Al2O3+3TiC
(5)P和Q两种物质都是由A、C、D、G四种元素组成的盐,其水溶液都显酸性,等物质的量的P和Q恰好完全反应.写出该反应的离子方程式:H++HSO3-=SO2↑+H2O.
分析 A、B、C、D、E、F、G都是短周期元素,原子序数依次增大.A原子半径是短周期最小的,则A为H元素;B原子的最外层电子数比次外层电子层多3个,原子只能有2个电子层,最外层电子数为5,故B为N元素;F是地壳中含量最高的金属元素,则F为Al;B、C处于同一周期,处于第二周期,D、E、F同处另一周期,即处于第三周期,D、C可按原子个数比2:l和1:1分别形成两种离子化合物甲和乙,可推知C为O、D为Na,则甲为Na2O、乙为Na2O2;C、G同主族,则G为S元素;E的原子序数介于Na、Al之间,故E为Mg,据此解答.
解答 解:A、B、C、D、E、F、G都是短周期元素,原子序数依次增大.A原子半径是短周期最小的,则A为H元素;B原子的最外层电子数比次外层电子层多3个,原子只能有2个电子层,最外层电子数为5,故B为N元素;F是地壳中含量最高的金属元素,则F为Al;B、C处于同一周期,处于第二周期,D、E、F同处另一周期,即处于第三周期,D、C可按原子个数比2:l和1:1分别形成两种离子化合物甲和乙,可推知C为O、D为Na,则甲为Na2O、乙为Na2O2;C、G同主族,则G为S元素;E的原子序数介于Na、Al之间,故E为Mg.
(1)B为N元素,处于周期表中第二周期第VA族,乙为Na2O2,电子式为 ,
,
故答案为:第二周期第VA族; ;
;
(2)同周期自左而右原子半径增大,一般电子层越多原子半径越大,故原子半径:O<N<S<Al<Mg<Na,
故答案为:O<N<S<Al<Mg<Na;
(3)F、D的最高价氧化物对应的水化物分别为Al(OH)3、NaOH,二者反应离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(4)单质Al、石墨和二氧化钛(TiO2)按比例混合,高温下反应得到的两种化合物均由两种元素组成,其中有一种产物是TiC,另外的化合物为Al2O3,其反应化学方程式为:4Al+3C+3TiO2$\frac{\underline{\;高温\;}}{\;}$2Al2O3+3TiC,
故答案为:4Al+3C+3TiO2$\frac{\underline{\;高温\;}}{\;}$2Al2O3+3TiC;
(5)P和Q两种物质都是由H、O、Na、S四种元素组成的盐,其水溶液都显酸性,应是NaHSO3与NaHSO4,二者等物质的量恰好完全反应,该反应的离子方程式:H++HSO3-=SO2↑+H2O,
故答案为:H++HSO3-=SO2↑+H2O.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,侧重对会化学用语的考查,注意对基础知识的理解掌握.

 名校课堂系列答案
名校课堂系列答案①用碱式滴定管量取25.00mL溴水
②不宜用瓷坩埚灼烧氢氧化钠或碳酸钠
③测定溶液的pH时用干燥,洁净的玻璃棒蘸取溶液,点在用蒸馏水润湿过的pH试纸上,再与标准比色卡比较
④圆底烧瓶、锥形瓶、烧杯加热时都应垫上石棉网
⑤使用容量瓶配制溶液时,俯视刻度线定容后所得溶液浓度偏高
⑥滴定用的锥形瓶和滴定管都要用所盛溶液润洗.
| A. | ①③④⑤ | B. | ②③⑤⑥ | C. | ②④⑤ | D. | ②④⑥ |
| A. | Na+、Mg2+、Al3+、Cl- | B. | Na+、AlO2-、Cl-、OH- | ||
| C. | Na+、Mg2+、Al2O-、Cl- | D. | Na+、Al3+、Al2O-、Cl- |
| A. | 工业上生产水泥、玻璃、陶瓷,均需要用石灰石为原料 | |
| B. | 石英是良好的半导体材料,可以制成光电池,将光能直接转化为电能 | |
| C. | 面粉中禁止添加CaO2、过氧化苯甲酰等增白剂,CaO2属于碱性氧化物 | |
| D. | 地沟油由于混有一些对身体有害的杂质而不能食用,可加工制成生物柴油,生物柴油的成分与从石油中提取的柴油成分不同 |
| A. | 1:3 | B. | 3:2 | C. | 1:4 | D. | 2:7 |
 已知含3molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示,则下列判断不正确的是( )
已知含3molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示,则下列判断不正确的是( )| A. | 还原性:HSO${\;}_{3}^{-}$>I-,氧化性:IO${\;}_{3}^{-}$>I2>SO${\;}_{4}^{2-}$ | |
| B. | a点处的氧化产物是SO${\;}_{4}^{2-}$,还原产物是I- | |
| C. | 当溶液中的I-为0.4mol时,加入的KIO3一定为0.4mol | |
| D. | 若向KIO3溶液中滴加NaHSO3溶液,反应开始时的离子方程式为:2IO${\;}_{3}^{-}$+5HSO${\;}_{3}^{-}$═I2+5SO${\;}_{4}^{2-}$+3H++H2O |
| A. | 月球上的H2O分子中只含有非极性共价键 | |
| B. | H2O在化学反应中既可作氧化剂又可作还原剂 | |
| C. | 氢的三种同位素H、D、T与16O只能形成三种水分子 | |
| D. | 在标准状况下,1mol水的体积约是22.4L |
 已知:①图中每个小三角形的三种物质中至少含有一种相同元素,H与I含有完全相同的元素.②A、J为固体单质,D为气体单质,其余物质为常见化合物.③B为淡黄色化合物,B与H反应能生成D.④E为常见金属氧化物.⑤F的溶液和H反应生成白色胶状沉淀G.
已知:①图中每个小三角形的三种物质中至少含有一种相同元素,H与I含有完全相同的元素.②A、J为固体单质,D为气体单质,其余物质为常见化合物.③B为淡黄色化合物,B与H反应能生成D.④E为常见金属氧化物.⑤F的溶液和H反应生成白色胶状沉淀G. .
.