题目内容
过氧乙酸是一种广谱消毒剂,是抗“非典”中一种重要消毒剂,可用过氧化氢与乙酸反应制取,调节乙酸和过氧化氢的浓度可得到不同浓度的过氧乙酸.
过氧乙酸含量的分析方法如下:
准确称取0.5027g过氧乙酸试样(含有杂质H2O2),置于预先盛有40mL H2O、5mL 3mol/L H2SO4溶液和2~3滴1mol/L MnSO4溶液并已冷却至5℃的碘量瓶中,摇匀,用0.02366mol/L KMnO4标准溶液滴定(反应Ⅰ)至溶液呈浅粉色(30s不褪色),消耗了12.49mL;随即加入10mL 20% KI溶液(反应Ⅱ)和2~3滴(NH4)2MoO4溶液(起催化作用并减轻溶液的颜色),轻轻摇匀,加塞,在暗处放置5~10min,用0.1018mol/L Na2S2O3标准溶液滴定(I2+2Na2S2O3=2NaI+Na2S4O6),接近终点时加入3mL 0.5%淀粉指示剂,继续滴定至蓝色消失,并保持30s不重新显色,为终点,消耗了Na2S2O3 23.61mL.
(1)写出与测定过程中的化学方程式Ⅰ和Ⅱ.
(2)计算过氧乙酸的质量分数(要求3位有效数字).
(3)滴定过程中KMnO4滴定有什么作用?
(4)过氧乙酸不稳定,易受热分解.写出热分解反应方程式.
过氧乙酸含量的分析方法如下:
准确称取0.5027g过氧乙酸试样(含有杂质H2O2),置于预先盛有40mL H2O、5mL 3mol/L H2SO4溶液和2~3滴1mol/L MnSO4溶液并已冷却至5℃的碘量瓶中,摇匀,用0.02366mol/L KMnO4标准溶液滴定(反应Ⅰ)至溶液呈浅粉色(30s不褪色),消耗了12.49mL;随即加入10mL 20% KI溶液(反应Ⅱ)和2~3滴(NH4)2MoO4溶液(起催化作用并减轻溶液的颜色),轻轻摇匀,加塞,在暗处放置5~10min,用0.1018mol/L Na2S2O3标准溶液滴定(I2+2Na2S2O3=2NaI+Na2S4O6),接近终点时加入3mL 0.5%淀粉指示剂,继续滴定至蓝色消失,并保持30s不重新显色,为终点,消耗了Na2S2O3 23.61mL.
(1)写出与测定过程中的化学方程式Ⅰ和Ⅱ.
(2)计算过氧乙酸的质量分数(要求3位有效数字).
(3)滴定过程中KMnO4滴定有什么作用?
(4)过氧乙酸不稳定,易受热分解.写出热分解反应方程式.
考点:化学方程式的有关计算
专题:常规题型,计算题
分析:(1)酸性KMnO4具有强氧化性,酸性条件下,KMnO4能将H2O2氧化生成O2;
过氧乙酸具有强氧化性,能将KI氧化生成I2,自身被还原生成乙酸;
(2)过氧乙酸具有强氧化性,能将KI氧化生成I2,I2和Na2S2O3发生氧化还原反应生成NaI、Na2S4O6,根据CH3COOOH---KI---I2---Na2S2O3之间的关系式计算CH3COOOH,从而计算CH3COOOH的质量分数;
(3)双氧水也具有氧化性,能被KI还原而影响CH3COOOH的测定;
(4)过氧乙酸不稳定,易受热分解生成乙酸和氧气.
过氧乙酸具有强氧化性,能将KI氧化生成I2,自身被还原生成乙酸;
(2)过氧乙酸具有强氧化性,能将KI氧化生成I2,I2和Na2S2O3发生氧化还原反应生成NaI、Na2S4O6,根据CH3COOOH---KI---I2---Na2S2O3之间的关系式计算CH3COOOH,从而计算CH3COOOH的质量分数;
(3)双氧水也具有氧化性,能被KI还原而影响CH3COOOH的测定;
(4)过氧乙酸不稳定,易受热分解生成乙酸和氧气.
解答:
解:(1)酸性KMnO4具有强氧化性,酸性条件下,KMnO4能将H2O2氧化生成O2,自身被还原生成硫酸锰,反应方程式为2KMnO4+3H2SO4+5H2O2=2MnSO4+K2SO4+5O2↑+8H2O,
过氧乙酸具有强氧化性,能将KI氧化生成I2,自身被还原生成乙酸,反应方程式为2KI+2H2SO4+CH3COOOH=2KHSO4+CH3COOH+H2O+I2,
答:反应I方程式为2KMnO4+3H2SO4+5H2O2=2MnSO4+K2SO4+5O2↑+8H2O;
反应II方程式为2KI+2H2SO4+CH3COOOH=2KHSO4+CH3COOH+H2O+I2;
(2)过氧乙酸具有强氧化性,能将KI氧化生成I2,发生的化学反应为2KI+2H2SO4+CH3COOOH=2KHSO4+CH3COOH+H2O+I2①;
I2和Na2S2O3发生氧化还原反应生成NaI、Na2S4O6,反应方程式为I2+2Na2S2O3=2NaI+Na2S4O6②;
根据方程式①②得关系式CH3COOOH---Na2S2O3,
设过氧乙酸的质量为x,
CH3COOOH------2Na2S2O3
76g 2mol
x 0.1018mol/L×0.02361L
76g:1mol=x:(0.1018mol/L×0.02361L)
x=
=0.09133g,
过氧乙酸质量分数=
=0.182,
答:过氧乙酸的质量分数为0.182;
(3)双氧水也具有氧化性,能被KI还原而影响CH3COOOH的测定,所以高锰酸钾的作用是除去双氧水,
答:高锰酸钾的作用是先除掉杂质双氧水;
(4)过氧乙酸不稳定,易受热分解生成乙酸和氧气,反应方程式为2CH3COOOH
2CH3COOH+O2↑,
答:该反应方程式为2CH3COOOH
2CH3COOH+O2↑.
过氧乙酸具有强氧化性,能将KI氧化生成I2,自身被还原生成乙酸,反应方程式为2KI+2H2SO4+CH3COOOH=2KHSO4+CH3COOH+H2O+I2,
答:反应I方程式为2KMnO4+3H2SO4+5H2O2=2MnSO4+K2SO4+5O2↑+8H2O;
反应II方程式为2KI+2H2SO4+CH3COOOH=2KHSO4+CH3COOH+H2O+I2;
(2)过氧乙酸具有强氧化性,能将KI氧化生成I2,发生的化学反应为2KI+2H2SO4+CH3COOOH=2KHSO4+CH3COOH+H2O+I2①;
I2和Na2S2O3发生氧化还原反应生成NaI、Na2S4O6,反应方程式为I2+2Na2S2O3=2NaI+Na2S4O6②;
根据方程式①②得关系式CH3COOOH---Na2S2O3,
设过氧乙酸的质量为x,
CH3COOOH------2Na2S2O3
76g 2mol
x 0.1018mol/L×0.02361L
76g:1mol=x:(0.1018mol/L×0.02361L)
x=
| 0.1018mol/L×0.02361L×76g |
| 2mol |
过氧乙酸质量分数=
| 0.09133g |
| 0.5027g |
答:过氧乙酸的质量分数为0.182;
(3)双氧水也具有氧化性,能被KI还原而影响CH3COOOH的测定,所以高锰酸钾的作用是除去双氧水,
答:高锰酸钾的作用是先除掉杂质双氧水;
(4)过氧乙酸不稳定,易受热分解生成乙酸和氧气,反应方程式为2CH3COOOH
| △ |
答:该反应方程式为2CH3COOOH
| △ |
点评:本题以过氧乙酸为载体考查滴定计算,侧重考查分析和计算能力,明确每一过程发生的反应是解本题关键,知道各种物质的性质,根据方程式进行计算即可,知道高锰酸钾的作用,题目难度中等.

练习册系列答案
 每课必练系列答案
每课必练系列答案
相关题目
某主族元素最外层只有1个电子,则该元素一定是( )
| A、ⅠA族元素 |
| B、第ⅦA元素 |
| C、第三周期元素 |
| D、金属元素 |
下列选项中正确的是( )
| A、甲苯和二氯乙烯分子中所有原子共平面 |
| B、1-丁烯既能发生取代反应,又能发生加成反应,但不能被氧化 |
| C、由甲苯制三硝基甲苯和苯甲酸都属于取代反应 |
| D、分子式为C3H6Cl2的同分异构体有4种 |
随着人们生活质量的提高,废电池必须集中处理的问题被提上议事日程,其首要原因是( )
| A、利用电池外壳的金属材料 |
| B、防止电池中汞、镉、铅等重金属离子对土壤和水源的污染 |
| C、回收其中的石墨电极 |
| D、不使电池中渗出的电解液腐蚀其他物品 |
下列各化合物的命名不正确的是( )
| A、CH2=CH-CH=CH2 1,3-二丁烯 |
B、 2-丁醇 2-丁醇 |
C、 邻二甲苯 邻二甲苯 |
D、 2-甲基丁烷 2-甲基丁烷 |
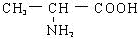 ⑥Al这六种物质中,既能与强酸溶液(如HCl),又能与强碱溶液(如NaOH)反应的有
⑥Al这六种物质中,既能与强酸溶液(如HCl),又能与强碱溶液(如NaOH)反应的有