题目内容
 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下问题:(1)若A、B都是惰性电极,c是饱和NaCl溶液,实验开始时,同时在U形管两边各滴入几滴酚酞试液,则:
①B是
②电解池中A极上的电极反应式为
B极上的电极反应式为
(2)如要进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,电解液c选用CuSO4溶液,则:
①A电极的材料是
②B电极的材料是
(说明:杂质发生的电极反应不必写出)
③下列说法正确的是
a.电能全部转化为化学能
b.在电解精炼过程中,电解液中伴随有Al3+、Zn2+产生
c.溶液中Cu2+向阳极移动
d.利用阳极泥可回收Ag、Pt、Au等金属
(3)用惰性电极电解CuSO4溶液.若阴极析出Cu的质量为12.8g,则阳极上产生的气体在标准状况下的体积为
(4)利用反应2Cu+O2+2H2SO4═2CuSO4+2H2O可制备CuSO4,若将该反应设计为电解池,其电解质溶液需用
考点:电解原理
专题:电化学专题
分析:(1)①根据电流方向判断电源的正负极,再判断出电解槽的阴阳极及B电解的产物、现象;
②A极氯离子失去电子生成氯气,B极氢离子得到电子生成氢气;
(2)①A极为纯铜,铜离子得到电子反应还原反应;
②B极为纯铜,铜失去电子发生氧化反应;
③a.电能不能全部转化为化学能;
b.在电解精炼过程中,阳极上金属放电;
c.溶液中Cu2+向阴极移动;
d.在阳极的底部可回收不活泼金属;
(3)计算出铜的物质的量,根据电子守恒进行计算;
(4)该反应不能自发进行,所以只能设计成电解池,失电子的金属作阳极,反应方程式中溶液为电解质溶液,阴极上得电子发生还原反应.
②A极氯离子失去电子生成氯气,B极氢离子得到电子生成氢气;
(2)①A极为纯铜,铜离子得到电子反应还原反应;
②B极为纯铜,铜失去电子发生氧化反应;
③a.电能不能全部转化为化学能;
b.在电解精炼过程中,阳极上金属放电;
c.溶液中Cu2+向阴极移动;
d.在阳极的底部可回收不活泼金属;
(3)计算出铜的物质的量,根据电子守恒进行计算;
(4)该反应不能自发进行,所以只能设计成电解池,失电子的金属作阳极,反应方程式中溶液为电解质溶液,阴极上得电子发生还原反应.
解答:
解:(1)①根据电流方向可知,a为电源的正极,b为负极,A为电解池的阳极,B为阴极;电极B发生了还原反应,水电离的氢离子得到电子生成无色的氢气,电极反应为:2H2O+2e-=H2↑+2OH-,所以B极附近溶液呈红色,
故答案为:阴极;无色;红;
②A极氯离子放电,电极反应为:2Cl--2e-═Cl2,B极氢离子得到电子,电极反应为:2H++2e-═H2↑或2H2O+2e-═H2↑+2OH-;,
故答案为:2Cl--2e-═Cl2↑;2H++2e-═H2↑或2H2O+2e-═H2↑+2OH-;
(2)①电解方法精炼粗铜,电解池的阴极材料是纯铜,电极反应为:Cu2++2e-=Cu,
故答案为:纯铜;Cu2++2e-=Cu;
②电解方法精炼粗铜,电解池的阳极材料是粗铜,电极反应为:Cu-2e-═Cu2+,
故答案为:粗铜;Cu-2e-═Cu2+;
③a.电能不能全部转化为化学能,还有部分转化为热能,故错误;
b.在电解精炼过程中,阳极上金属放电,所以电解液中伴随有Al3+、Zn2+产生,故正确;
c.溶液中Cu2+向阴极移动,故错误;
d.在阳极的底部可回收不活泼金属,如Ag、Pt、Au,故正确;
故选:bd;
(3)电解硫酸铜溶液时,阳极上氢氧根离子放电,生成1mol氧气需要4mol电子,根据转移电子相等得阳极上产生的气体在标准状况下的体积=
×22.4L/mol=2.24L,
故答案为:2.24;
(4)该反应不能自发进行,所以只能设计成电解池,失电子的金属作阳极,反应方程式中溶液为电解质溶液,阴极上得电子发生还原反应,所以若将该反应设计为电解池,其电解质溶液需用稀硫酸,阳极材料是用铜,阴极电极反应式为O2+4H++4e-═2H2O,
故答案为:H2SO4(aq);铜;O2+4H++4e-═2H2O.
故答案为:阴极;无色;红;
②A极氯离子放电,电极反应为:2Cl--2e-═Cl2,B极氢离子得到电子,电极反应为:2H++2e-═H2↑或2H2O+2e-═H2↑+2OH-;,
故答案为:2Cl--2e-═Cl2↑;2H++2e-═H2↑或2H2O+2e-═H2↑+2OH-;
(2)①电解方法精炼粗铜,电解池的阴极材料是纯铜,电极反应为:Cu2++2e-=Cu,
故答案为:纯铜;Cu2++2e-=Cu;
②电解方法精炼粗铜,电解池的阳极材料是粗铜,电极反应为:Cu-2e-═Cu2+,
故答案为:粗铜;Cu-2e-═Cu2+;
③a.电能不能全部转化为化学能,还有部分转化为热能,故错误;
b.在电解精炼过程中,阳极上金属放电,所以电解液中伴随有Al3+、Zn2+产生,故正确;
c.溶液中Cu2+向阴极移动,故错误;
d.在阳极的底部可回收不活泼金属,如Ag、Pt、Au,故正确;
故选:bd;
(3)电解硫酸铜溶液时,阳极上氢氧根离子放电,生成1mol氧气需要4mol电子,根据转移电子相等得阳极上产生的气体在标准状况下的体积=
| ||
| 4 |
故答案为:2.24;
(4)该反应不能自发进行,所以只能设计成电解池,失电子的金属作阳极,反应方程式中溶液为电解质溶液,阴极上得电子发生还原反应,所以若将该反应设计为电解池,其电解质溶液需用稀硫酸,阳极材料是用铜,阴极电极反应式为O2+4H++4e-═2H2O,
故答案为:H2SO4(aq);铜;O2+4H++4e-═2H2O.
点评:本题考查学生电解池的工作原理知识,明确图中电源的正负极确定电解池的阴阳极是解答的关键,并熟悉电极反应及离子的放电顺序来解答,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 如图是某反应体系中的三种气态物质M、N、P的物质的量浓度随时间的变化情况,则下列判断不正确的是( )
如图是某反应体系中的三种气态物质M、N、P的物质的量浓度随时间的变化情况,则下列判断不正确的是( )| A、该反应的化学方程式可表达为2M+N?2P |
| B、在反应时间为20min-25min之内,物质M的反应速率为0.002mol/(L?min) |
| C、当反应时间为20min时,曲线开始发生变化的原理可能是由于增大压强引起的 |
| D、反应在10min达到化学平衡状态,若曲线的变化是由于升温造成的(其它条件不变),则该反应的正反应一定为吸热反应 |
用NA表示阿伏加德罗常数,66克CO2所含的氧原子数为( )
| A、NA |
| B、2NA |
| C、3NA |
| D、4NA |
下列有关四种基本反应类型与氧化还原反应关系的说法中正确的是( )
| A、化合反应一定是氧化还原反应 |
| B、分解反应一定不是氧化还原反应 |
| C、置换反应一定是氧化还原反应 |
| D、复分解反应不一定是氧化还原反应 |
下列物质的变质过程中,既有氧化还原反应,又有非氧化还原反应的是( )
| A、Ca(ClO)2 |
| B、NaOH |
| C、FeSO4 |
| D、Na2SO3 |
常温下,下列各组离子在指定溶液中能大量共存的是( )
| A、使甲基橙呈红色的溶液:NH4+、Na+、Al02-、HC03- | ||
| B、c(NH3?H2O)=1.Omol?L-1的溶液:K+、Al3+、S042-、Cl- | ||
| C、由水电离的c(H+)=10-12mol?L-1的溶液:K+、Ba2+、Cl-、Br- | ||
D、在
|
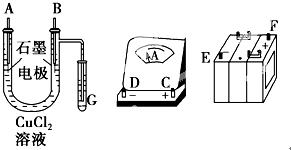 某学生试图用电解法根据电极上析出物质的质量来验证阿伏加德罗常数值,其实验方案的要点为:
某学生试图用电解法根据电极上析出物质的质量来验证阿伏加德罗常数值,其实验方案的要点为:
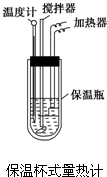 在量热计中(如图)将100mL 0.50mol?L-1的CH3COOH溶液与100mL 0.55mol?L-1的NaOH溶液混合,温度从298.0K升高至300.7K.已知量热计的热容常数(量热计各部件每升高1K所需要的热量)是150.5J?K-1,溶液密度均为1g?mL-1,生成溶液的比热容c=4.184J?(g?K)-1.
在量热计中(如图)将100mL 0.50mol?L-1的CH3COOH溶液与100mL 0.55mol?L-1的NaOH溶液混合,温度从298.0K升高至300.7K.已知量热计的热容常数(量热计各部件每升高1K所需要的热量)是150.5J?K-1,溶液密度均为1g?mL-1,生成溶液的比热容c=4.184J?(g?K)-1.