题目内容
7.标准状况下,一支试管充满NH3,把它倒立于水槽中,因NH3极易溶于水,水充满试管(假设溶质不从试管中溢出)则氨水的物质的量浓度为( )| A. | $\frac{1}{22.4}$mol/L | B. | $\frac{1}{44.8}$mol/L | C. | $\frac{1}{33.6}$mol/L | D. | 无法计算 |
分析 设烧瓶容积为VL,根据n=$\frac{V}{{V}_{m}}$、c=$\frac{n}{V}$计算出实验结束后烧瓶中氨水的物质的量浓度.
解答 解:设烧瓶容积为VL,则烧瓶内氨气的物质的量为:$\frac{VL}{22.4L/mol}$=$\frac{V}{22.4}$mol,实验结束后烧瓶中氨水的物质的量浓度为:c=$\frac{\frac{V}{22.4}mol}{VL}$=$\frac{1}{22.4}$mol/L,
故选A.
点评 本题考查氨气的性质以i物质的量浓度的计算,为高频考点,试题侧重基础知识的考查,培养了学生的分析能力及化学计算能力,难度不大.

练习册系列答案
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案
相关题目
17.第119号某未知元素,有人称之为“类钫”.根据周期表结构及元素性质的变化趋势,下列有关“类钫”的预测说法错误的是( )
| A. | “类钫”在化合物中呈+1价 | |
| B. | 类钫具有放射性 | |
| C. | 单质与水反应较为缓慢 | |
| D. | 类钫最高价氧化物对应的水化物是强碱 |
15.用以下装置和试剂构成一个原电池(如图),下列叙述正确的是( )
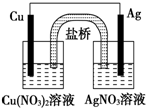

| A. | 将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同 | |
| B. | 该电池的负极反应为:Ag++e-═Ag | |
| C. | 在外电路中,电子由银电极流向铜电极 | |
| D. | 实验过程中取出盐桥,原电池仍继续工作 |
2.向明矾溶液中滴入氢氧化钡溶液,当SO42-沉淀完全时,铝元素的存在形式是( )
| A. | Al(OH)3 和Al3+ | B. | Al(OH)3 和AlO2- | C. | 全部为Al(OH)3 | D. | 全部为AlO2- |
12.下列离子在溶液中能大量共存的是( )
| A. | HCO3-、NH4+、H+、Cl- | B. | AlO2-、OH-、Na+、Cl- | ||
| C. | AlO2-、H+、MnO4-、NO3- | D. | Mg2+、Fe3+、NO3-、OH- |
19.下列有关丙烯醛( CH2=CH-CHO)的叙述中,不正确的是( )
| A. | 可使溴水溶液褪色 | B. | 不能与酸性高锰酸钾溶液反应 | ||
| C. | 能发生银镜反应 | D. | 一定条件下能发生加聚反应 |
16.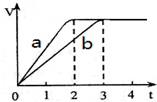 镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图所示,下列说法正确的是( )
镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图所示,下列说法正确的是( )
 镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图所示,下列说法正确的是( )
镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图所示,下列说法正确的是( )| A. | 曲线a代表Al的反应过程,曲线b代表Mg的反应过程 | |
| B. | Mg和Al的质量之比为3:2 | |
| C. | Mg和Al的物质的量之比为3:2 | |
| D. | Mg和Al的反应速率之比为3:2 |