题目内容
7.反应A+3B=2C+2D在不同条件下反应速率如下,其中最快的是( )| A. | v(A)=0.15 mol/(L•min) | B. | v(B)=0.6 mol/(L•min) | ||
| C. | v(C)=0.4 mol/(L•min) | D. | v(D)=0.8 mol/(L•min) |
分析 化学反应速率与化学计量数成正比,则反应速率与化学计量数的比值越大,反应速率越快,以此来解答.
解答 解:反应速率与化学计量数的比值越大,反应速率越快,则
A.$\frac{0.15}{1}$=0.15;
B.$\frac{0.6}{3}$=0.2;
C.$\frac{0.4}{2}$=0.2;
D.$\frac{0.8}{2}$=0.4,
显然D中比值最大,反应速率最快,
故选D.
点评 本题考查反应速率的比较,为高频考点,把握化学计量数与反应速率的关系为解答的关键,侧重分析与应用能力的考查,注意比值法应用及速率单位统一,题目难度不大.

练习册系列答案
相关题目
17.下列叙述不正确的是( )
| A. | 钾、钠、镁等活泼金属着火时,不能用泡沫灭火器灭火 | |
| B. | 为准确配制一定物质的量浓度的溶液,定容过程中向容量瓶内加蒸馏水至接近刻度线下1~2cm时,改用胶头滴管滴加蒸馏水至刻度线 | |
| C. | 蒸馏完毕后,应先停止加热,待装置冷却后,停止通水,再拆卸蒸馏装置 | |
| D. | 探究温度对硫代硫酸钠与硫酸反应速率的影响时,若先将两种溶液混合并计时,再用水浴加热至设定温度,则测得的反应速率偏高 |
15.被称为“软电池”的纸质电池,采用一个薄层纸片(在其一边镀锌,在其另一边镀二氧化锰)作为传导体.在纸内的离子“流过”水和氧化锌组成的电解液.电池总反应为Zn+2MnO2+H2O═ZnO+2MnO(OH)下列说法不正确的是( )
| A. | 该电池锌为负极,发生氧化反应 | |
| B. | 电池正极反应式为MnO2+e-+H2O═MnO(OH)+OH- | |
| C. | 当0.1mol Zn完全溶解时,电池外电路转移的电子个数约为1.204×1023 | |
| D. | 当该电池工作时,负极周围的pH值变大 |
2.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,22.4L苯中含σ键数目为12NA | |
| B. | 常温下,9.2gNO2和N2O4的混合气体中含有的氮原子数目为0.2NA | |
| C. | 常温下,1.0L 0.1 mol•L-1 FeCl3溶液中,Fe3+离子数目为0.1NA | |
| D. | O3氧化NO 结合水洗可产生HNO3和O2,每生成1mol HNO3转移的电子数为6NA |
12.可逆反应在一定条件下达到化学平衡状态的标志是( )
| A. | 反应停止了 | B. | 反应物与生成物物质的量相等 | ||
| C. | 反应物和生成物浓度相等 | D. | 正反应速率与逆反应速率相等 |
19.下列解释事实的方程式不正确的是( )
| A. | 电解饱和食盐水,产生黄绿色气体:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑ | |
| B. | 用Na2CO3溶液将水垢中的CaSO4转化为CaCO3:CO32-+Ca2+=CaCO3 | |
| C. | 向H2O2溶液中滴加CuSO4溶液,产生气泡:2H2O2 $\frac{\underline{\;CuSO_{4}\;}}{\;}$2H2O+O2↑ | |
| D. | 向苯酚浊液中滴加Na2CO3溶液,溶液变澄清: |
17.下列各组顺序的排列正确的是( )
| A. | 最高正价:P<S<Cl<Ar | B. | 热稳定性:H2O>HF>HCl | ||
| C. | 酸性强弱:HNO3<H2CO3<H3PO4 | D. | 还原性 F-<Cl-<Br- |
18.下列各装置能组成原电池的是( )
| A. |  乙醇 | B. | 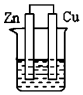 稀H2SO4 | C. |  稀H2SO4 | D. |  稀H2SO4 |
 某有机物含C、H、N、O四种元素,下图为该有机物球棍模型.
某有机物含C、H、N、O四种元素,下图为该有机物球棍模型.