题目内容
将NH4Cl 固体置于试管底部,加热,观察到试管底部固体小时,在试管口出现白色晶体,该变化过程的本质是 .
考点:铵盐
专题:氮族元素
分析:加热的过程中氯化铵分解,NH4Cl
NH3↑+HCl↑,生成的氨气和氯化氢气体,在管口附近温度降低,此两种气体又相互反应变成NH4Cl重新附着下来
NH3+HCl=NH4Cl,此过程是氯化铵的分解和氨气与氯化氢的化合反应过程,属于化学变化;
| ||
NH3+HCl=NH4Cl,此过程是氯化铵的分解和氨气与氯化氢的化合反应过程,属于化学变化;
解答:
解:将NH4Cl固体置于试管底部加热,加热的过程发生反应:NH4Cl
NH3↑+HCl↑,
但是在管口附近温度降低,此两种气体又相互反应变成NH4Cl重新附着下来,发生的反应为:NH3+HCl=NH4Cl;
这是氯化铵的分解之后,HCL和NH3又化合,是化学变化;
故答案为:将NH4Cl固体置于试管底部加热,加热的过程发生反应:NH4Cl
NH3↑+HCl↑,
但是在管口附近温度降低,此两种气体又相互反应变成NH4Cl重新附着下来,发生的反应为:NH3+HCl=NH4Cl;
这是氯化铵的分解之后,HCL和NH3又化合,是化学变化;
| ||
但是在管口附近温度降低,此两种气体又相互反应变成NH4Cl重新附着下来,发生的反应为:NH3+HCl=NH4Cl;
这是氯化铵的分解之后,HCL和NH3又化合,是化学变化;
故答案为:将NH4Cl固体置于试管底部加热,加热的过程发生反应:NH4Cl
| ||
但是在管口附近温度降低,此两种气体又相互反应变成NH4Cl重新附着下来,发生的反应为:NH3+HCl=NH4Cl;
这是氯化铵的分解之后,HCL和NH3又化合,是化学变化;
点评:本题考查了铵盐性质的分析判断,注意氯化铵分解后的气体重新形成氯化铵的反应过程理解,掌握基础是关键,题目较简单.

练习册系列答案
 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案
相关题目
下列说法正确的是( )
| A、SiCl4、PCl5分子中各原子最外层均达到8电子稳定结构 |
B、右表中的数字代表的是元素的原子序数.表中数字所对应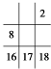 的元素与它们在周期表中的位置是相符的 的元素与它们在周期表中的位置是相符的 |
| C、元素的化学性质主要决定于核外电子数 |
| D、元素周期表中金属和非金属元素分界线附近的元素没有用于制造半导体材料的 |
2012年6月5日世界环境日的中国主题是:“绿色消费 你行动了吗?”联合国环境署将绿色经济定义为绿色经济是促成提高人类福祉和社会公平,同时显著降低环境风险和减少生态稀缺的经济.下列做法不符合这一主题的是( )
| A、在含硫的燃煤中加入适量生石灰 |
| B、使用酒精、天然气代替部分或全部燃油 |
| C、在汽油中添加四乙基铅提高汽油的稳定性和燃烧效率 |
| D、推广利用微生物发酵技术,将植物桔杆、动物粪便等制成沼气以替代液化石油气 |
已知反应:①101Kpa时,2C(s)+O2(g)=2CO(g);△H=-221kJ/mol
②稀溶液中,H+(aq)+OH-(aq)=H2O(1);△H=-57.3kJ/mol
下列结论正确的是( )
②稀溶液中,H+(aq)+OH-(aq)=H2O(1);△H=-57.3kJ/mol
下列结论正确的是( )
| A、碳的燃烧热等于110.5 kJ/mol |
| B、①的反应热为221 kJ/mol |
| C、稀硫酸与稀NaOH溶液反应的中和热为57.3kJ/mol |
| D、稀醋酸与稀 NaOH溶液反应生成 1mol水,放出 57.3kJ热量 |
下列物质与水作用形成的溶液不能与NH4Cl反应生成NH3的是( )
| A、生石灰 | B、钠 |
| C、过氧化钠 | D、氯气 |
物质的量浓度相同的下列溶液中,含离子和分子种类最多的是( )
| A、MgCl2 |
| B、CH3COONa |
| C、氨水 |
| D、K2CO3 |
下列说法正确的是( )
| A、H-H键无方向性 |
| B、基态C原子有两个未成对电子,所以最多只能形成2个共价键 |
| C、1个N原子最多只能与3个H原子结合形成NH3分子,是由共价键的饱和性决定的 |
| D、所有的原子轨道都具有一定的伸展方向,因此所有的共价键都具有方向性 |