题目内容
3.二氧化氯( ClO2)是一种极易爆炸的强氧化性气体,在生产和使用时必须尽量用“惰性”气体进行稀释,并尽可能防止震动和避光.因此,二氧化氯的制备方法一直是科学家长期寻求解决的问题,目前比较理想的方法是用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得.已知,ClO2在常温下是一种黄绿色有刺激性气味的气体,其熔点为一59℃,沸点为11.0℃,易溶于水.某学生拟用图1所示装置模拟工业制取并收集ClO2.
(1)A中反应产物有K2CO3、ClO2和CO2等,请写出该反应的化学方程式:2KClO3+H2C2O4$\frac{\underline{\;60℃\;}}{\;}$K2CO3+2ClO2↑+CO2↑+H2O.A装置必须添加温度控制装置,除酒精灯外,还需要的玻璃仪器有烧杯、温度计.
(2)B装置必须放在冰水浴中,其原因是使ClO2充分冷凝以减少挥发.
(3)反应后在装置C中可得NaClO2溶液.已知(1)NaClO2饱和溶液在温度低于38℃时析出晶体是NaClO2.3H2O,在温度高于38℃时析出晶体是NaClO2,温度高于60℃时NaClO2分解生成NaClO3和NaCl; NaClO2的溶解度曲线如图2所示,请补充从NaClO2溶液中制得NaClO2晶体的操作步骤:
①减压,55℃蒸发结晶;②趁热过滤;③用38℃~60℃热水洗涤;④低于60℃干燥;得到成品.
(4)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液.为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:量取ClO2溶液10mL,稀释成100mL试样.
步骤2:量取V1 mL试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,摇匀,在暗处静置30min.
步骤3:以淀粉溶液作指示剂,用c mol.L-1 Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL.(已知2Na2S2O3+I2═Na2S4O6+2NaI)
①若步骤2中未将锥形瓶“在暗处静置30min”,立即进行步骤3,则测定的结果可能(选填“偏大”、“偏小”或“无影响”).
②上述步骤3中滴定终点的现象是滴入最后一滴Na2S2O3溶液后溶液由蓝色变为无色,且30s不变色.
③根据上述步骤可计算出原ClO2溶液的浓度为$\frac{135c{V}_{2}}{{V}_{1}}$g.L-1,(用含字母的代数式表示)
分析 (1)由题目信息,可知KClO3和H2C2O4反应生成K2CO3、ClO2和CO2,由H元素守恒应有水生成;该反应需要控制60℃温度,使用水浴加热,需要用温度计;
(2)ClO2的沸点为11.0℃,易挥发,应充分冷却以减少挥发;
(3)从溶液中制取晶体,一般采用蒸发结晶、过滤、洗涤、干燥的方法,注意温度控制,为防止析出晶体NaClO2•3H2O,应趁热过滤;
(4)①在暗处静置是为了使ClO2与KI充分反应,若不静置,ClO2反应不完全;
②淀粉遇碘变蓝色,Na2S2O3溶液会消耗碘单质,滴定完毕颜色会褪去;
③ClO2溶液与碘化钾反应的离子方程式:2ClO2+10I-+8H+=5I2+2Cl-+4H2O,由I2+2S2O32-=2I-+S4O62-,可得ClO2~5S2O32-,据此计算.
解答 解:(1)由题目信息,可知KClO3和H2C2O4反应生成K2CO3、ClO2和CO2,由H元素守恒应有水生成,反应方程式为:2KClO3+H2C2O4$\frac{\underline{\;60℃\;}}{\;}$K2CO3+2ClO2↑+CO2↑+H2O,该反应需要控制60℃温度,使用水浴加热,需要用温度计,
故答案为:2KClO3+H2C2O4$\frac{\underline{\;60℃\;}}{\;}$K2CO3+2ClO2↑+CO2↑+H2O;温度计;
(2)ClO2的沸点为11.0℃,易挥发,B装置必须放在冰水浴中,可以使ClO2充分冷凝以减少挥发,
故答案为:使ClO2充分冷凝以减少挥发;
(3)从溶液中制取晶体,一般采用蒸发结晶、过滤、洗涤、干燥的方法,为防止析出晶体NaClO2•3H2O,应趁热过滤,由题目信息可知,应控制温度38℃~60℃进行洗涤,低于60℃干燥,
故答案为:趁热过滤;用38℃~60℃热水洗涤;
(4)①在暗处静置是为了使ClO2与KI充分反应,若不静置,ClO2反应不完全,生成的碘偏小,故测得的结果就偏小,故答案为:偏小;
②淀粉遇碘变蓝色,Na2S2O3溶液会消耗碘单质,故滴定终点现象为:滴入最后一滴Na2S2O3溶液后溶液由蓝色变为无色,且30s不变色,
故答案为:滴入最后一滴Na2S2O3溶液后溶液由蓝色变为无色,且30s不变色;
③ClO2溶液与碘化钾反应的离子方程式:2ClO2+10I-+8H+=5I2+2Cl-+4H2O,由I2+2S2O32-=2I-+S4O62-,可得ClO2~5S2O32-,原ClO2溶液的浓度为:[V2×10-3×cmol/mol×$\frac{1}{5}$×$\frac{100mL}{{V}_{1}mL}$×67.5g/mol]÷0.01L=$\frac{135c{V}_{2}}{{V}_{1}}$g/L,
故答案为:$\frac{135c{V}_{2}}{{V}_{1}}$.
点评 本题考查物质实验制备方案、对题目信息的迁移应用、物质的分离提纯、滴定应用等,理解原理是解题的关键,同时考查学生分析问题、解决问题的能力,难度较大.

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案| A. | Cu与石墨都能导电,但都属于非电解质 | |
| B. | AgCl与BaSO4都是难溶性盐,但都属于强电解质 | |
| C. | SO2与CaO都是氧化物,因此SO2、CaO都是非电解质 | |
| D. | NaCl与HCl都是电解质,因此熔融NaCl、液态HCl都能导电 |
| A. |  向一定量的饱和石灰水中加入氧化钙 | |
| B. |  加热一定量高锰酸钾固体产生氧气 | |
| C. |  用一定量的双氧水制取氧气 | |
| D. |  向一定量的硝酸银溶液中插入铜丝 |
| A. | Na+ Ag+ CO32- Cl- | B. | K+ Ba2+SO42- Cl- | ||
| C. | Na+ K+ CO32- Cl- | D. | Na+ K+ Cl- SO42- |
b.SO2、Na2S、Na2CO3反应可生成Na2S2O3.
某化学小组据此进行了制备硫代硫酸钠晶体(Na2S2O3•5H2O)的探究.实验制备装置如图所示(省略夹持装置):
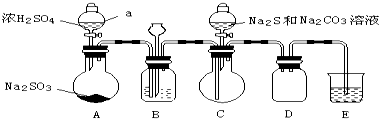
回答问题:
(1)仪器a的名称是分液漏斗.
(2)装置B的作用之一是观察SO2的生成速率.B中最好盛装的液体是c.
a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
(3)在装置C中生成Na2S2O3.
①完成反应方程式:4SO2+2Na2S+1Na2CO3=3Na2S2O3+CO2
②反应开始先使A中发生反应一会儿,再使C中反应发生,其原因是排除装置内空气,防止发生氧化生成Na2SO4.
③结束反应后,取C中溶液,经蒸发浓缩、冷却结晶、过滤、洗涤、干燥、得到Na2S2O3•5H2O.
(4)完成对所得产品的检测的实验:
| 推测 | 操作和现象 | 结论 |
| 杂质中的正盐成分可能有: Na2S Na2CO3 Na2SO3 Na2SO4 | ①取Wg产品配成稀溶液; ②向溶液中滴加过量BaCl2溶液,有白色沉淀生成,过滤,得沉淀和滤液; ③向沉淀中加入过量盐酸,沉淀完全溶解,并有刺激性气味的气体产生. | 产品杂质中: 一定含有Na2SO3, 可能含有Na2CO3 Na2S, 一定不含有Na2SO4. |
C6H8O6+I2═C6H6O6+2H++2I- 2S2O32-+I2═S4O62-+2I-
在一定体积的某维生素C溶液中加入a mol•L-1I2溶液V1mL,充分反应后,用Na2S2O3溶液滴定剩余的I2.上述滴定时,采用淀粉作指示剂,判断滴定终点的现象是滴加最后一滴Na2S2O3标准液时溶液由蓝色变为无色且半分钟内不变色.消耗b mol•L-1Na2S2O3溶液V2mL.该溶液中维生素C的物质的量是(aV1-$\frac{b{V}_{2}}{2}$)×10-3mol.
| A. | 氢气通过灼热的CuO粉末 | B. | 二氧化碳通过Na2O2粉末 | ||
| C. | 铝与氧化铁高温下发生反应 | D. | 将锌粒投入FeCl2溶液 |

 .
.