题目内容
12. 天然气的主要成分甲烷燃烧生成二氧化碳和液态水的化学方程式是:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H═-889.6kJ/mol
天然气的主要成分甲烷燃烧生成二氧化碳和液态水的化学方程式是:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H═-889.6kJ/mol请回答下列问题:
(1)反应物能量总和大于(填“大于”、“小于”或“等于”)生成物能量总和.
(2)如图所示的装置是由CH4、O2和KOH溶液组成的新型燃料电池.
①该电池的负极电极反应式是CH4+10OH--8e-═CO32-+7H2O.正极电极反应式是2O2+4H2O+8e-=8OH-.
②电池工作一段时间后电解质溶液的pH减小(填“增大”、“减小”或“不变”).
分析 (1)根据热化学方程式中△H的符号分析;
(2)如图所示的装置是由CH4、O2和KOH溶液组成的新型燃料电池.
①该电池的负极是CH4、发生氧化反应,电极反应式为:CH4+10OH--8e-═CO32-+7H2O;②总的电极反应式为CH4+2OH-+2O2=CO32-+3H2O.
解答 解:(1)已知CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-889.6kJ/mol,反应是放热反应,所以反应物能量总和大于生成物能量总和,故答案为:大于;(2)①该电池的负极是CH4,电a为负极,发生氧化反应,电极反应式为:CH4+10OH--8e-═CO32-+7H2O,正极是氧气得电子,生成氢氧根离子,电极反应式为:2O2+4H2O+8e-=8OH-;故答案为:CH4+10OH--8e-═CO32-+7H2O;2O2+4H2O+8e-=8OH-;
②总的电极反应式为CH4+2OH-+2O2=CO32-+3H2O,由总的电极反应式可知:氢氧根离子的浓度减小,所以溶液的PH值减小,故答案为:减小.
点评 本题考查了化学反应中能量的变化,原电池原理原理,明确原电池电极上发生反应的类型即可分析解答本题,难度不大.

练习册系列答案
相关题目
4.下列描叙中,正确的是( )
| A. | Cl2以液态形式存在时可称作氯水或液氯 | |
| B. | 玛瑙的主要成分是二氧化硅 | |
| C. | 加碘食盐中所加的“碘”是KIO3 | |
| D. | 漂白粉的主要成分是次氯酸钙 |
5.下列叙述正确的是( )
| A. | 聚乙烯能使溴水褪色 | |
| B. | 葡萄糖能发生氧化反应和水解反应 | |
| C. | CH2═CHCN通过缩聚反应得到腈纶 | |
| D. | 区别棉花和羊毛的最简单方法是灼烧闻气味 |
2.下列转变需加入还原剂的是( )
| A. | Fe2+→Fe3+ | B. | Cl-→Cl2 | C. | Mg(OH)2→MgO | D. | MnO4-→MnO2 |
7.锂电池具有高能量、寿命长、可靠性高等优点,即使是在非常低的温度下作业也能有出色的表现.某种锂电池的总反应为Li+MnO2═LiMnO2,下列说法不正确的是( )
| A. | Li是负极,电极反应为Li-e-═Li+ | |
| B. | 锂电池属于一次性电池 | |
| C. | MnO2是正极,电极反应为MnO2+e-═MnO${\;}_{2}^{-}$ | |
| D. | 锂电池是一种环保型电池 |
17.下列物质属于电解质的是( )
| A. | 氯化钠溶液 | B. | 氨水 | C. | 硝酸钾 | D. | 铝制导线 |
1.用下列装置进行的实验中,不能达到相应实验目的是( )
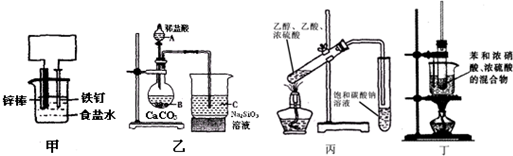

| A. | 装置甲:防止铁钉生锈 | B. | 装置乙:验证C的非金属性强于Si | ||
| C. | 装置丙:实验室制取乙酸乙酯 | D. | 装置丁:实验室制备硝基苯 |
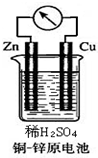 如图所示的铜-锌原电池中,理论上应观察到的现象是:
如图所示的铜-锌原电池中,理论上应观察到的现象是: