题目内容
4.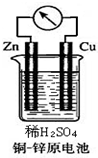 如图所示的铜-锌原电池中,理论上应观察到的现象是:
如图所示的铜-锌原电池中,理论上应观察到的现象是:①铜片上:有气泡生成,
②此时原电池的电极反应式是:
正极:2H++2e-=H2↑负极:Zn-2e-=Zn2+;
③若生成的氢气在标况下的体积为4.48L,则反应过程中有0.4mol电子转移.在相同温度下,同样大小的混有碳粒等杂质的锌比纯锌与同浓度同体积的稀硫酸反应的速率要快(选填“要快”、“要慢”、“相等”、“无法确定”)
分析 铜、锌、稀硫酸构成的原电池中,锌易失电子作负极,铜作正极,负极上失电子发生氧化反应,正极上得电子发生还原反应,据此分析解答.
解答 解:铜、锌、稀硫酸构成的原电池中,锌易失电子发生氧化反应而作负极,负极上电极反应式为 Zn-2e-=Zn2+,锌片逐渐溶解;铜作正极,正极上氢离子得电子发生还原反应,电极反应式为2H++2e-=H2↑,铜电极上有氢气生成,所以看到的现象是铜片上有气泡产生,若有0.2摩尔电子转移,依据电极反应计算得到生成氢气物质的量为0.2mol,
①铜作正极,正极上氢离子得电子发生还原反应,电极反应式为2H++2e-=H2↑,铜电极上有氢气生成,所以看到的现象是铜片上有气泡产生,
故答案为:有气泡生成;
②铜、锌、稀硫酸构成的原电池中,锌易失电子发生氧化反应而作负极,负极上电极反应式为 Zn-2e-=Zn2+,锌片逐渐溶解;铜作正极,正极上氢离子得电子发生还原反应,电极反应式为2H++2e-=H2↑,
故答案为:2H++2e-=H2↑;Zn-2e-=Zn2+;
③若生成的氢气在标况下的体积为4.48L,氢气的物质的量为$\frac{4.48L}{22.4L/mol}$=0.2mol,所以有0.2×2mol电子转移,原电池加快反应速率;
故答案为:0.4;要快.
点评 本题考查了原电池原理,明确正负极上得失电子、反应类型、电极反应式的书写即可解答,难度不大.

练习册系列答案
相关题目
16.下列分散系中,分散质粒子的直径大小在1nm~100nm之间的是( )
| A. | CuSO4溶液 | B. | 豆浆 | C. | 稀硫酸 | D. | 浑浊的石灰水 |
17.离子方程式H++OH-═H2O所表示的反应是( )
| A. | 所有酸和碱之间的中和反应 | |
| B. | 所有强酸和强碱之间的中和反应 | |
| C. | 所有可溶性酸和可溶性碱之间的中和反应 | |
| D. | 强酸溶液与强碱溶液生成可溶性盐和水的反应 |
19.运用下列装置和操作能达到实验目的和要求的是( )
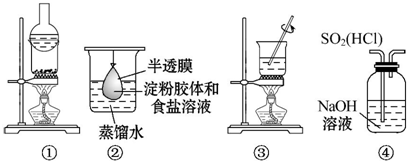

| A. | 用①分离氯化铵和单质碘 | |
| B. | 用②除去淀粉溶液中的氯化钠 | |
| C. | 用③加热胆矾(CuSO4•5H2O)制取无水硫酸铜 | |
| D. | 用④装置除去SO2中的HCl |
9. 红曲色素是通过中国传统工业发酵得到的天然色素,用作食品色素安全性很高,同时具有抑菌、防腐和保健作用.其中一种成分--红斑红素结构如图所示,下列有关红斑红素的说法正确的是( )
红曲色素是通过中国传统工业发酵得到的天然色素,用作食品色素安全性很高,同时具有抑菌、防腐和保健作用.其中一种成分--红斑红素结构如图所示,下列有关红斑红素的说法正确的是( )
 红曲色素是通过中国传统工业发酵得到的天然色素,用作食品色素安全性很高,同时具有抑菌、防腐和保健作用.其中一种成分--红斑红素结构如图所示,下列有关红斑红素的说法正确的是( )
红曲色素是通过中国传统工业发酵得到的天然色素,用作食品色素安全性很高,同时具有抑菌、防腐和保健作用.其中一种成分--红斑红素结构如图所示,下列有关红斑红素的说法正确的是( )| A. | 分子中环上的所有原子都在同一平面上 | |
| B. | 红斑红素的分子式为C21H24O5 | |
| C. | 1 mol该物质能与5 mol Br2发生加成反应 | |
| D. | 1 mol 该物质水解时能消耗2 mol NaOH |
16.用铝热法还原下列化合物,当各制得1mol金属单质时,消耗铝的质量最少的是( )
| A. | WO3 | B. | Fe3O4 | C. | MnO2 | D. | V2O5 |
13.某含一个碳碳双键的烃与H2加成后的产物是: ,则该烃的结构式可能有( )
,则该烃的结构式可能有( )
 ,则该烃的结构式可能有( )
,则该烃的结构式可能有( )| A. | 2种 | B. | 4种 | C. | 5种 | D. | 3种 |
 天然气的主要成分甲烷燃烧生成二氧化碳和液态水的化学方程式是:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H═-889.6kJ/mol
天然气的主要成分甲烷燃烧生成二氧化碳和液态水的化学方程式是:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H═-889.6kJ/mol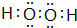 ,并指明A2C2分子中化学键的类型共价键(或极性共价键和非极性共价键).
,并指明A2C2分子中化学键的类型共价键(或极性共价键和非极性共价键).