题目内容
3.在标准状况下,有物质①4gH2,②33.6LCH4,③1molH2O,④3.01×1023个O2,含分子数最多的是(填序号,下同)①,含原子数最少的是④,质量最大的是②,体积最小的③;密度由大到小的顺序为:③>④>②>①.分析 根据n=$\frac{N}{{N}_{A}}$=$\frac{V}{{V}_{m}}$=$\frac{m}{M}$计算氢气、甲烷、氧气的物质的量,物质的量越大,分子数越多;
结合分子含有原子数目计算各物质含有的原子物质的量;
根据m=nM计算水、氧气、甲烷质量;
相同条件下,物质的量越大,气体的体积越大;
相同条件下,气体密度之比等于其相对分子质量之比.
解答 解:在标准状况下,有物质:
①4gH2的物质的量为$\frac{4g}{2g/mol}$=2mol,含有的原子的物质的量为4mol,其体积在标况下为44.8L;
②33.6LCH4的物质的量为$\frac{33.6L}{22.4L/mol}$=1.5mol,含有的原子的物质的量为6mol,质量为1.5mol×16g/mol=24g;
③1molH2O的质量为18g,含有的原子的物质的量为3mol,在标况下体积约为18mL;
④3.01×1023个O2的物质的量为$\frac{3.01×1{0}^{23}}{6.02×1{0}^{23}mo{l}^{-1}}$=0.5mol,含有的原子的物质的量为1mol,质量为0.5mol×32g/mol=16g;
则含分子数最多的是①,含原子数最少的是④,质量最大的是②,体积最小的③;相同条件下,气体密度之比等于其相对分子质量之比,水为液体密度最大,所以密度由大到小的顺序为:③>④>②>①;
故答案为:①;④;②;③;③>④>②>①.
点评 本题考查物质的量有关计算,明确物质的量公式中各个物理量之间关系及分子构成是解本题关键,题目难度不大.

练习册系列答案
相关题目
13.大气污染中,PM2.5是主要污染物之一,PM2.5是指大气中直径约为2.5微米的颗粒物,也称为可吸入肺颗粒物.根据以上信息你认为下列分散质中分散质粒子直径与PM2.5最接近的是(1微米=10-6m)( )
| A. | 石灰水 | B. | 豆浆 | C. | 泥水 | D. | 蔗糖水 |
11.能正确表示下列反应的离子方程式是( )
| A. | 将磁性氧化铁溶于稀硫酸:Fe3O4+8H+=3Fe3++4H2O | |
| B. | 0.2mol明矾与300mL1mol/L的氢氧化钡溶液混合:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ | |
| C. | 将氯化亚铁溶液和稀硝酸混合:Fe2++4H++NO3-=Fe3++2H2O+NO↑ | |
| D. | 将铁粉加入稀硫酸中:2Fe+6H+=2Fe3++3H2↑ |
18.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,22.4 L水中所含原子总数为3NA | |
| B. | 常温常压下,44 gC3H8中含有的碳碳单键数为3NA | |
| C. | 标准状况下,44.8 L NO与22.4L O2混合后,气体分子总数为3NA | |
| D. | 1 molNa2O和Na2O2混合物中含有的阴.阳离子总数是3NA |
8.反应C(s)+H2O(g)?CO(g)+H2(g)在一可变容积的密闭容器中进行,在其他条件不变的情况下,下列条件的改变对其反应速率几乎无影响的是( )
| A. | 保持体积不变,充入H2O(g)使体系压强增大 | |
| B. | 将容器的体积缩小一半 | |
| C. | 保持体积不变,充入N2使体系压强增大 | |
| D. | 保持压强不变,充入N2使容器体积变大 |
15.下列物质可用分液漏斗分离的是( )
| A. | 碘与酒精 | B. | 硝基苯与水 | C. | 苯与溴苯 | D. | 乙酸与水 |
13.实验室配制500mL 0.1mol•L-1Na2CO3溶液时,不需要用到的仪器是( )
| A. |  托盘天平 | B. |  容量瓶 | C. |  胶头滴管 | D. |  分液漏斗 |
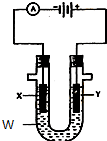 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液w;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液w;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: