题目内容
有盐酸、硫酸、醋酸三种溶液,试回答:
(1)若三种溶液的浓度均为0.1mol?L-1,中和一定量NaOH溶液生成正盐时,需上述三种酸的体积依次是V1L、V2L、V3L,其大小关系为 .
(2)若三种溶液的pH都为2,分别取10mL上述溶液加水稀释至1000mL,此时三种溶液的pH依次为pH1、pH2、pH3,其大小关系为 (用“<”、“>”或“=”表示)
(1)若三种溶液的浓度均为0.1mol?L-1,中和一定量NaOH溶液生成正盐时,需上述三种酸的体积依次是V1L、V2L、V3L,其大小关系为
(2)若三种溶液的pH都为2,分别取10mL上述溶液加水稀释至1000mL,此时三种溶液的pH依次为pH1、pH2、pH3,其大小关系为
考点:弱电解质在水溶液中的电离平衡
专题:
分析:(1)中和一定量NaOH溶液生成正盐时,酸的浓度相等时,如果是一元酸,所用酸的体积相等,如果是二元酸,酸的体积是一元酸的一半;
(2)稀释浓度相等的酸,促进弱电解质电离.
(2)稀释浓度相等的酸,促进弱电解质电离.
解答:
解(1)中和一定量NaOH溶液生成正盐时,酸的浓度相等,如果是一元酸,所用酸的体积相等,如果是二元酸,酸的体积是一元酸的一半,所以三种酸的体积大小关系是V1=V3>V2,故答案为:V1=V3>V2;
(2)硫酸是二元强酸,盐酸是一元强酸,醋酸是一元弱酸,PH相等的三种酸,氢离子浓度相等,加水稀释促进醋酸电离,所以稀释后溶液中氢离子浓度①=②<③,则溶液中pH1=pH2>pH3,故答案为:pH1=pH2>pH3.
(2)硫酸是二元强酸,盐酸是一元强酸,醋酸是一元弱酸,PH相等的三种酸,氢离子浓度相等,加水稀释促进醋酸电离,所以稀释后溶液中氢离子浓度①=②<③,则溶液中pH1=pH2>pH3,故答案为:pH1=pH2>pH3.
点评:本题考查了中碱中和、弱电解质的电离、溶液的稀释等,题目综合性较强,难度中等.

练习册系列答案
相关题目
下列说法正确的是( )
| A、1molOH-的质量是17g |
| B、氢气的摩尔质量是2g |
| C、摩尔是物质的质量的单位 |
| D、气体摩尔体积约为22.4L/mol |
相同温度下,根据三种酸的电离常数,下列判断正确的是( )
| 酸 | HX | HY | HZ |
| 电常数 | 9×10-7 | 9×10-6 | 10-2 |
| A、三种酸的强弱关系:HX>HY>HZ |
| B、反应 HZ+Y-═HY+Z-够发生 |
| C、相同温度下,0.1 mol?L-1的NaX、NaY、NaZ溶液,NaZ溶液pH最大 |
| D、相同温度下,1 mol?L-1HX溶液的电离常数大于0.1 mol?L-1HX |
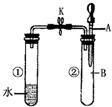 如图所示,试管①中盛有96℃的水,试管②中充满气体 B,将液体A滴入试管②中,充分反应后打开夹子K,发现试管①中的水立刻沸腾.则A与B可能是( )
如图所示,试管①中盛有96℃的水,试管②中充满气体 B,将液体A滴入试管②中,充分反应后打开夹子K,发现试管①中的水立刻沸腾.则A与B可能是( )| A、水与氮气 |
| B、稀硫酸与一氧化碳 |
| C、浓氢氧化钠溶液与二氧化碳 |
| D、饱和食盐水与氯气 |
漆酚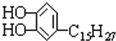 是我国特产漆的主要成分漆酚不应具有的化学性质( )
是我国特产漆的主要成分漆酚不应具有的化学性质( )
 是我国特产漆的主要成分漆酚不应具有的化学性质( )
是我国特产漆的主要成分漆酚不应具有的化学性质( )| A、可以跟Na2CO3溶液反应放出CO2 |
| B、可以使酸性KMnO4溶液褪色 |
| C、可以跟FeCl3溶液发生显色反应 |
| D、可以跟溴水发生取代反应 |
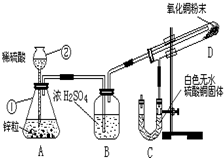 某学生为了验证氢气还原氧化铜的产物,设计了如图所示的实验装置.
某学生为了验证氢气还原氧化铜的产物,设计了如图所示的实验装置.