题目内容
钠、镁、铝与水反应的将剧烈程度依次减弱,则金属性最强的是: ,最高价氧化物对应的水化物分别是: 、 、 ,它们的碱性强弱顺序: .
考点:同一周期内元素性质的递变规律与原子结构的关系
专题:
分析:同周期从左到右金属元素的金属性逐渐减弱,与水反应的将剧烈程度依次减弱,对应最高价氧化物的水化物的减小逐渐减弱,据此分析.
解答:
解:同周期从左到右金属元素的金属性逐渐减弱,与水反应的将剧烈程度依次减弱,则钠、镁、铝金属性最强的是Na;钠、镁、铝的最高价氧化物对应的水化物分别为NaOH、Mg(OH)2、Al(OH)3;同周期从左到右金属元素的对应最高价氧化物的水化物的碱性逐渐减弱,所以碱性:NaOH>Mg(OH)2>Al(OH)3,
故答案为:Na;NaOH、Mg(OH)2、Al(OH)3;NaOH>Mg(OH)2>Al(OH)3.
故答案为:Na;NaOH、Mg(OH)2、Al(OH)3;NaOH>Mg(OH)2>Al(OH)3.
点评:本题考查同一周期元素性质递变规律,侧重于第三周期金属元素性质递变规律的考查,题目难度不大.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
下列物质间的转化关系中,M不能为( )
M
氧化物
酸或碱
盐.
M
| O2 |
| H2O |
| +NaOH或HCl |
| A、钠 | B、氮气 | C、木炭 | D、硫 |
铝片与盐酸的反应属于( )
| A、吸热反应 |
| B、放热反应 |
| C、氧化还原反应 |
| D、非氧化还原反应 |
14 6 |
14 6 |
| A、质子数为14 |
| B、中子数为6 |
| C、电子数为6 |
| D、质量数为8 |
有关化学用语不正确的是( )
| A、CO2分子的结构式:O=C=O | ||
B、O-18的原子符号:
| ||
C、S2-离子的结构示意图: | ||
D、氯化氢分子的电子式: |
设阿伏加德罗常数为NA,下列说法正确的是( )
| A、1 mol Cl2与足量Fe反应,转移的电子数为3NA |
| B、常温常压下,14g氮气中含有 NA个原子 |
| C、标准状况下,22.4L水中含有的原子数为3NA |
| D、在25℃、101 kPa时,22.4 L氢气中含有NA个氢分子 |
下列方程式书写不正确的是( )
| A、NaHS水解:HS-+H2O?H2S+OH- |
| B、氢氧化钡溶于水电离:Ba(OH)2═Ba2++2OH- |
| C、醋酸溶于水电离:CH3COOH?CH3COO-+H+ |
| D、碳酸钠水解:CO32-+2H2O?2OH-+H2CO3 |
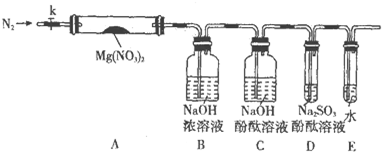 固体硝酸盐加热易分解且产物较复杂.已知KNO3、Cu(NO3)2、AgNO3三种硝酸盐的热分解反应方程式如下:
固体硝酸盐加热易分解且产物较复杂.已知KNO3、Cu(NO3)2、AgNO3三种硝酸盐的热分解反应方程式如下: