题目内容
16.现有500g 20℃的A物质溶液,若保持温度不变,蒸发掉20g水后,有5g A析出,若再蒸发掉20g水后,又有7g A析出,则在20℃时A物质的溶解度是35g.分析 有500g 20℃的A物质溶液,若保持温度不变,蒸发掉20g水后,有5g A析出,此时得到的溶液为饱和溶液,若再蒸发掉20g水后,又有7g A析出,说明20g水中溶解了7g溶质A,结合溶解度的表达式进行计算.
解答 解:有500g 20℃的A物质溶液,若保持温度不变,蒸发掉20g水后,有5g A析出,此时得到的溶液为饱和溶液,若再蒸发掉20g水后,又有7g A析出,说明20g水中溶解了7g溶质A,
设该温度下A的溶解度为S,则:$\frac{S}{100g}$=$\frac{7g}{20g}$,解得:S=35g,
故答案为:35g.
点评 本题考查了溶解度的计算,题目难度不大,明确第一次蒸发出20g水后得到溶液为饱和溶液为解答关键,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
6.2015年10月,浙江籍科学家屠呦呦因发现青蒿素(C15H22O5)而获得诺贝尔生理学或医学奖.根据物质的分类,青蒿素属于( )
| A. | 碱性氧化物 | B. | 有机物 | C. | 含氧酸盐 | D. | 酸性氧化物 |
7.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 含有2NA个氧原子的氧气与臭氧的混合气体的质量为16g | |
| B. | 标准状况下,22.4 mL水中含有的分子数目约为1.24NA | |
| C. | 300 mL 2 mol•L-1酒精溶液中所含分子数为0.6 NA | |
| D. | 1 mol Cl2参加的任何反应转移电子数都是2NA |
11.下列说法不正确的是( )
| A. | 原电池反应的本质是氧化还原反应 | |
| B. | 化学反应能量变化的主要原因是化学键的断裂与形成 | |
| C. | 石墨转化为金刚石的反应是吸热反应,说明金刚石比石墨稳定 | |
| D. | 元素周期律的实质是元素原子核外电子排布呈周期性变化 |
1.将少量SO3气体通入BaCl2稀溶液中,下列说法正确的是( )
| A. | 发生反应:SO3+H2O+BaCl2═BaSO4↓+2HCl | |
| B. | 产生蓝色沉淀 | |
| C. | 有气体生成 | |
| D. | 若将SO2通入BaCl2溶液中,也会产生与SO3通入BaCl2溶液中相同的现象 |
3.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 常温常压下,48g O3含有的分子数为NA | |
| B. | 1molNa2O2晶体中阴离子数为2 NA | |
| C. | 标准状况下,33.6L的 四氯化碳(CCl4)中含有的碳原子数目为1.5NA | |
| D. | 常温常压下,7.1 g Cl2与足量的Fe充分反应,转移的电子数目为0.3 NA |
4.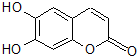 中草药秦皮中含有的七叶树内酯(如图)具有抗菌作用.若1mol该物质分别与浓溴水和H2完全反应,则消耗的Br2和H2的物质的量最多分别为( )
中草药秦皮中含有的七叶树内酯(如图)具有抗菌作用.若1mol该物质分别与浓溴水和H2完全反应,则消耗的Br2和H2的物质的量最多分别为( )
 中草药秦皮中含有的七叶树内酯(如图)具有抗菌作用.若1mol该物质分别与浓溴水和H2完全反应,则消耗的Br2和H2的物质的量最多分别为( )
中草药秦皮中含有的七叶树内酯(如图)具有抗菌作用.若1mol该物质分别与浓溴水和H2完全反应,则消耗的Br2和H2的物质的量最多分别为( )| A. | 2molBr2 3molH2 | B. | 2molBr2 4molH2 | C. | 3molBr2 4molH2 | D. | 3molBr2 5molH2 |