题目内容
在标准状况下15 g CO与CO2的混合气体,体积为11.2 L.则:
(1)混合气体的平均摩尔质量是
(2)混合气体中C、O原子个数比为 .
(1)混合气体的平均摩尔质量是
(2)混合气体中C、O原子个数比为
考点:物质的量的相关计算
专题:
分析:(1)根据n=
计算混合气体总物质的量,再根据
=
计算混合气体平均摩尔质量;
(2)根据 CO与CO2的总质量、总物质的量列方程计算 CO与CO2的物质的量,进而计算混合气体中C、O原子个数比.
| V |
| Vm |
. |
| M |
| m总 |
| n总 |
(2)根据 CO与CO2的总质量、总物质的量列方程计算 CO与CO2的物质的量,进而计算混合气体中C、O原子个数比.
解答:
解:(1)混合气体总物质的量为
=0.5mol,故混合气体平均摩尔质量为
=30g/mol,故答案为:30g/mol;
(2)设CO与CO2的物质的量分别为xmol、ymol,则:
解得x=
y=
混合气体中C、O原子个数比为0.5mol:(
mol+
mol×2)=8:9,
故答案为:8:9.
| 11.2L |
| 22.4L/mol |
| 15g |
| 0.5mol |
(2)设CO与CO2的物质的量分别为xmol、ymol,则:
|
解得x=
| 7 |
| 16 |
| 1 |
| 16 |
混合气体中C、O原子个数比为0.5mol:(
| 7 |
| 16 |
| 1 |
| 16 |
故答案为:8:9.
点评:本题考查物质的量有关计算,难度不大,注意理解掌握对以物质的量为中心的有关计算.

练习册系列答案
 发散思维新课堂系列答案
发散思维新课堂系列答案
相关题目
实验室需配制一种强酸溶液500mL,且要求c (H+)=2mol/L,下列配制方法可行的是( )
| A、取100mL5mol/LH2SO4,加入400mL水 |
| B、取200mL5mol/LHCl,加水稀释至500mL |
| C、取100 mL5mol/LH2SO4,加水500mL |
| D、取100 mL5mol/LHNO3,加水稀释至500mL |
关于1molH2O的说法正确的是( )
| A、质量18g |
| B、体积22.4L |
| C、分子数为1 |
| D、含有O原子的物质的量为2mol |
下列计算或推导结果正确的是( )
| A、10.8 g X2O5中含有0.5 mol O,则X的相对原子质量为28 |
| B、4 g某气体含有的分子数为3.01×1023,则2 g该气体在标准状况下的体积是5.6 L |
| C、同温同压下,10 L X2气体跟30 L Y2气体化合生成20 L某Z气体,则Z的化学式为XY2 |
| D、标准状况下,相同质量的N2、O2、Cl2中,体积最大的是Cl2 |
下列关于阿伏加德罗常数的说法不正确的是( )
| A、阿伏加德罗常数是一个纯数,没有单位 |
| B、常用NA表示阿伏加德罗常数 |
| C、阿伏加德罗常数是一个实验值 |
| D、阿伏加德罗常数常用:6.02×1023mol-1 |
摩尔是( )单位.
| A、质量 | B、密度 |
| C、相对分子质量 | D、物质的量 |
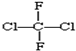 和
和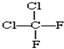 ; ⑨
; ⑨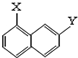 和
和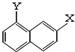 .
. 研究氮的氧化物、硫的氧化物、碳的氧化物等大气污染物的处理具有重要意义.
研究氮的氧化物、硫的氧化物、碳的氧化物等大气污染物的处理具有重要意义.